
 ,试推测(A)和(B)的结构式.
,试推测(A)和(B)的结构式.| 加氢 |
| 臭氧 |
| Zn/H2O |
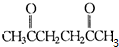 ,而根据碳碳双键的性质:
,而根据碳碳双键的性质: ),这两步反应合在一起,称为“烯键的臭氧分解”来分析.
),这两步反应合在一起,称为“烯键的臭氧分解”来分析. ),可知:A
),可知:A| 臭氧 |
| Zn/H2O |
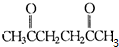 即发生了此类反应,故可知A的结构简式为:
即发生了此类反应,故可知A的结构简式为: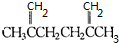 ,而A
,而A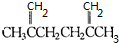
| 加氢 |
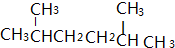 .
.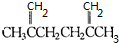 ,B的结构简式为
,B的结构简式为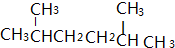 .
.


科目:高中化学 来源: 题型:

| Ⅰ |
| Ⅱ |
| Ⅲ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、葡萄糖和蛋白质都可以发生水解 |
| B、油脂和聚乙烯都是高分子化合物 |
| C、煤和石油都属于不可再生能源 |
| D、淀粉和纤维素互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有羟基的化合物一定是醇 |
| B、分子内有苯环和羟基的化合物一定是酚 |
| C、苯甲醇与2-甲基苯酚互为同分异构体 |
| D、酚和醇具有相同的官能团,因而具有相同的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
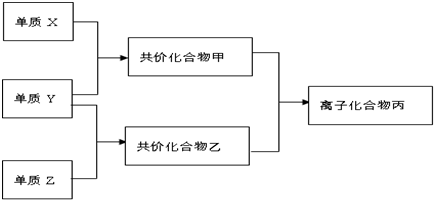
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有机物CH3O-C6H4-CHO,有多种同分异构体,其中属于酯且含有苯环结构的共有5种 |
B、某有机物的结构简式为 ,它的同分异构体中属于芳香醇的共有5种 ,它的同分异构体中属于芳香醇的共有5种 |
| C、对于化学式为C5H12O2的二元醇(不考虑,两个羟基连在同1个碳上的情况),其主链为4个碳原子的同分异构体有6种 |
| D、结构不同的二甲基氯苯的数目有6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10s | B、大于10s |
| C、小于10s | D、无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com