
(A).【物质结构与性质】
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| A | |||||||||||||||||
| B | C | ||||||||||||||||
| D | E | ||||||||||||||||
试回答下列问题:
(1)请写出元素D的基态原子电子排布式 ;
(2)D、E两元素的部分电离能数据列于下表:
| 元 素 | D | E | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态D2+再失去一个电子比气态E2+再失去一个电子难。对此,你的解释是 ;
(3)A的氢化物的中心原子的杂化形式为 ;C在空气中燃烧产物的分子构型为 ,与其互为等电子体的单质的分子式为 。
 (4)B单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中B原子的配位数为 ,一个晶胞中B原子的数目为 。
(4)B单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中B原子的配位数为 ,一个晶胞中B原子的数目为 。
(B).【实验化学】
牙膏是生活必需品。下面是牙膏中某些主要成分的检验流程图,。

请回答下列问题:
(1)在①中加水、搅拌、静置后,接下来的实验操作名称是 ,所需要的主要玻璃仪器有 。
(2)在②中用pH试纸测溶液的pH的操作方法是 。
(3)写出④中发生反应的化学方程
式: 。
(4)将⑤中放出的气体通入澄清的石灰水中时,未见沉淀出现,则可能的原因是 、
(任答两条)。
(5)在⑥中检验Ca2+的存在,除可用焰色反应外,还可利用Ca2+和 溶液的反应来进行。
(A)(1)1s22s22p63s23p63d54s2 (2分)
(2) Mn2+的3d轨道电子排布为半满状态较稳定 (2分)
(3)sp3 (2分) V型(或角型)(2分) O3 (2分)
(4) 12 (1分) 4 (1分)
(B).(1)倾析法过滤 玻璃棒、烧杯 (4分)
(2)用玻璃棒蘸取少量待测液将其点在洁净干燥表面皿中的pH试纸上,再与标准比色卡进行对比(2分)
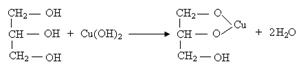 (3)
(3)
(2分)
(4)(略)(2分)
(5)草酸铵(或GBHA碱性)(2分)
(A)元素D是Mn;E是Fe;A的氢化物是NH3 ;C在空气中燃烧产物是SO2;B是Al, 单质晶体中原子的堆积为铜型
(B).(1)倾析法过滤 玻璃棒、烧杯 (4分)
(2)用玻璃棒蘸取少量待测液将其点在洁净干燥表面皿中的pH试纸上,再与标准比色卡进行对比(2分)
 (3)
(3)
(2分)
(4)(略)(2分)
(5)草酸铵(或GBHA碱性)(2分)


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:

| 元 素 | D | E | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
 【物质结构与性质】
【物质结构与性质】| m | n |
查看答案和解析>>
科目:高中化学 来源: 题型:
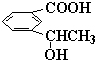

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com