
| 选项 | ① | ② | ③ | 实验结论 | 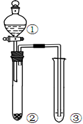 |
| A | 稀硫酸 | Na2CO3 | C6H5ONa | 酸性:H2CO3>C6H5OH | |
| B | 液溴和苯 | 铁屑 | AgNO3溶液 | 液溴和苯发生取代反应 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐可以生成白色沉淀 | |
| D | 浓盐酸 | KMnO4 | FeBr2溶液 | 氧化性:Cl2>Br2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.发生强酸制取弱酸的反应;
B.发生取代反应生成溴苯与HBr,但溴易挥发,溴、HBr均与硝酸银反应;
C.盐酸易挥发,酸性溶液中硝酸根离子、亚硫酸根离子发生氧化还原反应;
D.浓盐酸与高锰酸钾发生氧化还原反应生成氯气,氯气与FeBr2溶液反应,可氧化亚铁离子、溴离子.
解答 解:A.硫酸与碳酸钠反应生成二氧化碳,二氧化碳与苯酚钠反应生成苯酚,由强酸制取弱酸可知,酸性:H2CO3>C6H5OH,故A正确;
B.发生取代反应生成溴苯与HBr,但溴易挥发,溴、HBr均与硝酸银反应,则图中装置不能说明液溴和苯发生取代反应,故B错误;
C.盐酸易挥发,酸性溶液中硝酸根离子、亚硫酸根离子发生氧化还原反应,反应生成硫酸钡白色沉淀,结论不合理,故C错误;
D.浓盐酸与高锰酸钾发生氧化还原反应生成氯气,氯气与FeBr2溶液反应,可氧化亚铁离子、溴离子,则不能比较Br2、Fe3+的氧化性,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及酸性比较、氧化还原反应、有机物的性质等,把握化学反应原理及实验装置中的反应为解答的关键,注意实验操作的可行性、评价性分析,题目难度不大.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,有机物(CM3)2CHCH(CH2CH3)(CH2CH2CH3)的名称是:2-甲基-3-乙基己烷 | |
| B. |  与 与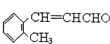 互为同系物 互为同系物 | |
| C. | 一定质量的甲烷、乙烯、乙醇在相同条件下充分燃烧耗氧量相同,则三者的质量大小关系为:乙醇>乙烯>甲烷 | |
| D. | 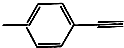 分子中所有原子共平面 分子中所有原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(W)>r(Y)>r(Z)>r(X) | |
| B. | X、Y、Z三种元素形成的化合物中只有共价键 | |
| C. | 最高价氧化物对应水化物的酸性:W>Y | |
| D. | 气态简单氢化物的热稳定性:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 试剂 |
| A | 除去Fe2O3中的Al2O3 | 稀盐酸 |
| B | 验证Br2的氧化性强于I2 | 溴水、KI溶液、淀粉溶液 |
| C | 检验溴乙烷中含有溴元素 | 溴乙烷、NaOH溶液、AgNO3溶液 |
| D | 制备Fe(OH)3胶体 | 饱和FeCl3溶液、NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、I2、Hg | B. | CO2、KCl、SiO2 | ||
| C. | HF、HCl、HBr | D. | CH4、C2H5OH、C4H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液溴保存时应加少量水并盛放在用玻璃塞塞紧的试剂瓶中 | |
| B. | 某气体通入品红溶液褪色,加热溶液又变红,该气体为SO2 | |
| C. | 配制硫酸亚铁溶液,可将绿矾晶体溶于蒸馏水并加入一定量的稀硫酸和铁屑 | |
| D. | 某溶液中加盐酸产生使澄清石灰水变浑浊的无色气体,则该溶液一定含CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NH3表示反应①的速率为1 mol/(L•min) | |
| B. | 体系中颜色不再变化时,可判断反应均已达平衡 | |
| C. | 该温度下反应①的平衡常数为20 mol2/L2 | |
| D. | 加压时反应②的平衡不会移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(H2PO4-)+c(HPO42-)+C(H3PO4) | |
| B. | c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-) | |
| C. | 温度升高,c(H2PO4-)增大 | |
| D. | 加水稀释后,m(H+)与m(OH-)的乘积不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100g98%的浓H2SO4中所含的氧原子数为4NA(NA为阿伏伽德罗常数,下同) | |
| B. | 3.1g白磷晶体中含有的P-P键数是0.6NA | |
| C. | 向Ca(HCO3)2溶液中加入Ca(OH)2溶液至过量:Ca2++2HCO3-+2OH-═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O | |
| D. | 冰水中常会形成(H2O)x(x≥1)分子,原因是存在氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com