
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中发生水解 |

分析 (1)A装置制备氯气,制备的氯气中含有HCl、水蒸气,用饱和食盐水除去HCl,B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,加热蒸馏,再冷凝收集NCl3,最后用氢氧化钠溶液吸收尾气,防止污染空气,据此排序;
(2)氯气、氯化氢都能引起空气污染,不能直接排放,应进行尾气处理,依据氯气、氯化氢性质选择合适的除杂剂;
(3)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(4)B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,还生成HCl;加热蒸馏出NCl3,NCl3的沸点为71℃,在95℃爆炸,可知控制蒸馏温度范围;
(5)NCl3本身无漂白性,与水反应生成次氯酸和氨气,氨气与水反应生成一水合氨,一水合氨电离出氢氧根离子,溶液显碱性,使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色,据此解答.
解答 解:(1)A装置制备氯气,制备的氯气中含有HCl、水蒸气,用饱和食盐水除去HCl,B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,加热蒸馏,再冷凝收集NCl3,最后用氢氧化钠溶液吸收尾气,防止污染空气,故仪器接口连接的顺序为:1、4、5、2、3、6、7、10、9、8,
故答案为:4、5 10、9、8;
(2)氯气、氯化氢都能引起空气污染,不能直接排放,可以用氢氧化钠溶液吸收,所以E中盛有氢氧化钠溶液;
故答案为:NaOH溶液;
(3)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,还生成HCl,反应方程式为:3Cl2+NH4Cl═NCl3+4HCl;加热蒸馏出NCl3,NCl3的沸点为71℃,在95℃爆炸,所以应控制蒸馏温度为71~95℃,
故答案为:3Cl2+NH4Cl═NCl3+4HCl;71~95℃;
3Cl2+NH4Cl═NCl3+4HCl; 71~95℃;
(5)NCl3本身无漂白性,与水反应生成次氯酸和氨气,化学方程式:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;,氨气与水反应生成一水合氨,一水合氨电离出氢氧根离子,溶液显碱性,使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色;
故答案为:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;NCl3本身无漂白性;NCl3在热水中水解生成NH3•H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色.
点评 本题考查物质制备与性质探究实验,关键是理解实验原理和各装置作用,侧重考查学生实验能力、分析能力,题目难度中等.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,1molN2和3molH2充分反应,生成物中的N-H键数目为6NA | |
| B. | 9.2g 由NO2和N2O4组成的混合物中含有氧原子的数目为 0.2NA | |
| C. | 完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA | |
| D. | 1L 0.1 mol•L-l的Na2S溶液中S2-和HS-的总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
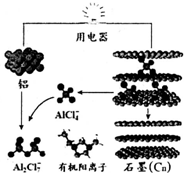 2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,铝为负极、石墨为正极 | |
| B. | 充电时的阳极反应为:Cn+AlCl4--e-=Cn AlCl4 | |
| C. | 放电时的负极反应为:Al-3e-+7 AlCl4-═4A12C17- | |
| D. | 放电时,有机阳离子向铝电极方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中存在两个平衡、七种粒子 | |
| B. | 该溶液中K+、NH4+、NO3-、Al3+可以大量共存 | |
| C. | 滴加少量稀硫酸,充分振荡无现象 | |
| D. | 通入足量SO2气体,发生反应的离子方程式:2S2-+SO2+2H2O═3S↓+4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物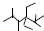 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 用酸性KMnO4 溶液可鉴别2-丁烯和正丁醛 | |
| C. | 用甘氨酸[H2N-CH2-COOH]和丙氨酸[CH3CH(NH2)COOH]缩合最多可形成3 种二肽 | |
| D. | 乙醇、乙二醇、丙三醇的沸点依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
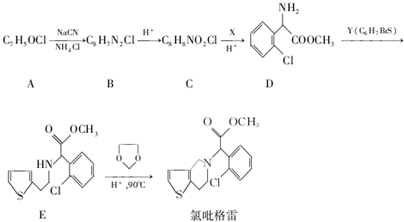
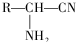 ,R-CN$\stackrel{H+}{→}$RCOOH
,R-CN$\stackrel{H+}{→}$RCOOH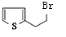 ,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种.
,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种.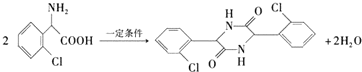 .
.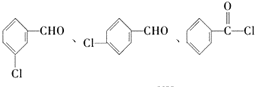 (不考虑立体异构).
(不考虑立体异构).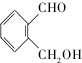 为有机原料制备化合物
为有机原料制备化合物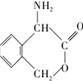 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).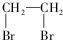 )
)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
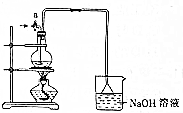 某化学探究小组为探究能与碳反应的浓硫酸的最低浓度,设计了如图实验装置进行实验.
某化学探究小组为探究能与碳反应的浓硫酸的最低浓度,设计了如图实验装置进行实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com