
| A、炼铁高炉中的主要反应是高温下CO与氧化铁发生反应炼出生铁 |
| B、锌与稀硫酸反应时加入少量硫酸铜,反应加快的原因是Cu2+水解增大了H+浓度 |
| C、C(s)+O2(g)=CO2(g)需点燃才能发生,说明该反应为吸热反应 |
| D、电解熔融氧化铝和冰晶石的混合物可制得金属铝 |
| ||


科目:高中化学 来源: 题型:
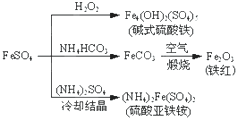
A、FeCO3转化为铁红的化学方程式:4FeCO3+O2
| ||||
| B、碱式硫酸铁因能水解产生Fe(OH)3胶体,故可用作净水剂 | ||||
| C、为检验暴露在空气中的(NH4)2Fe(SO4)2是否已被氧化,可选用KSCN溶液 | ||||
| D、常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q |
| B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
| C、若m+n=p+q,则向含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol |
| D、保持其它条件不变,升高温度,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 金属(粉末状) | 物质的量 | 酸的浓度 | 酸的体积 | 反应温度 |
| A | Al | 0.1mol | 18.4mol/LH2SO4 | 10mL | 60℃ |
| B | Mg | 0.1mol | 3mol/L H2SO4 | 10mL | 30℃ |
| C | Fe | 0.1mol | 3mol/L H2SO4 | 10mL | 60℃ |
| D | Mg | 0.1mol | 3mol/L H2SO4 | 10mL | 60℃ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素性质随着相对原子质量的递增而呈周期性的变化叫元素周期律 |
| B、同周期第ⅡA族与第IIIA族的元素原子序数之差可能为1、11或25 |
| C、在周期表中ⅠA族处寻找催化剂和耐高温的合金材料 |
| D、第三周期元素的离子半径,从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA |
| B、室温下PH=13的NaOH溶液中,由水电离的OH-的数目为0.1NA |
| C、氢氧燃料电池正极消耗22.4L(标况)气体时,电路中通过的电子数目是2NA |
| D、18gH2O含有10NA个质子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com