
【题目】25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol。下列热化学方程式书写正确的是( )
A. 2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-57.3kJ/mol
B. KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol
K2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol
C. C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(g) ΔH=-5518kJ/mol
O2(g)=8CO2(g)+9H2O(g) ΔH=-5518kJ/mol
D. 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1) ΔH=-5518kJ/mol
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A.常温下,1LpH=13的Ba(OH)2溶液中OH-数目为0.2NA
B.常温下,42g乙烯和丙烯的混合物中所含共价键的数目是9NA
C.标准状况下,11.2LSO3中含有的氧原子数目为1.5NA
D.1.0molCH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次 增大。在如图所示的物质转化关系中,p、q、 m.n分别是元素W、X、Y、Z的气体单质,p和 s均为有色气体,v的水溶液呈碱性。常温下,0.1 mol L -1 ,t 溶液与 0.1 mol L -1 u 溶液的pH均为1。下列说法不正确的是
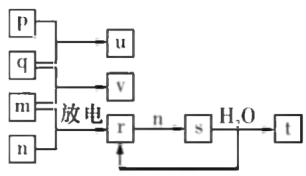
A.Y、W的兹高价氧化物对应的水化物均为强酸
B.元索的非金属性:Z>Y>X;原子半径:X<Z<Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.的电子式可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的容器中,对于反应 A(g)+2B(g)![]() 3C(g)(正反应为吸热反应),下列叙述为平衡状态标志的是
3C(g)(正反应为吸热反应),下列叙述为平衡状态标志的是
①体系的温度不再变化 ②外界条件不变时,A、B、C浓度保持不变 ③气体平均分子量不再变化 ④体系的压强不再变化 ⑤气体密度不再变化 ⑥3 v正(B)=2 v逆(C) ⑦单位时间内消耗1 mol A(g)的同时生成3 mol C(g)
A.①②⑥B.①②③⑤C.②③④⑤D.①②④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Ba(OH)2·8H2O固体与NH4Cl固体反应的化学方程式为_____________。
(2)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。理论上,每生成1 mol NH3___________热量(填“吸收”或“放出”)__________kJ;事实上,反应的热量总小于理论值,为什么?________________。
(3)一定条件下发生反应:6NO(g) + 4NH3(g)![]() 5N2(g) + 6H2O(g),某次实验中测得容器内NO及N2的物质的量随时间变化如下图甲所示,图中b点对应的速率关系是v(正) _____ v(逆) ; d点对应的速率关系是v(正) ___________ v(逆)。(填“﹥”、“﹤”或“﹦”)
5N2(g) + 6H2O(g),某次实验中测得容器内NO及N2的物质的量随时间变化如下图甲所示,图中b点对应的速率关系是v(正) _____ v(逆) ; d点对应的速率关系是v(正) ___________ v(逆)。(填“﹥”、“﹤”或“﹦”)

(4)已知N2(g)+ 3H2(g) ![]() 2NH3(g),若反应起始时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3达到平衡时浓度的范围为_______;若平衡时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3起始时浓度的范围为______。
2NH3(g),若反应起始时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3达到平衡时浓度的范围为_______;若平衡时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3起始时浓度的范围为______。
(5)已知一定条件下发生:2SO2(g) + O2(g) ![]() 2SO3(g) (正反应放热),在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)
2SO3(g) (正反应放热),在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)

t1________________________;t2________________________;
t3________________________;t4________________________。
(6)①某电池采用锂和石墨作电极,四氯化铝锂(LiAlCl4)溶解在亚硫酰氯中(SOCl2)组成电解质溶液,电池总反应为:8Li+3SOCl2=6LiCl+Li2SO3+2S,此电池中_______作正极,负极的电极反应为_________________。
②甲烷燃料电池示意图如上图乙,其负极反应方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取6根铁钉,6支干净的试管及其他材料,如图所示。
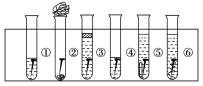
试管①放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触;
试管②在试管底部放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触;
试管③先放入一根铁钉,趁热倒入煮沸的蒸馏水(已赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触;
试管④中放入铁钉注入食盐水,使铁钉和空气及食盐水接触;
试管⑤放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片;
试管⑥放入相连的铁钉和铜丝,注入自来水,浸没铁钉和铜丝。
把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况。
(1)上述实验中铁钉发生了电化学腐蚀的是____(填试管序号);在电化学腐蚀中,负极反应是____,正极反应是______。
(2)从铁钉被腐蚀的情况可知引起和促进铁钉被腐蚀的条件是_________。
(3)为防止铁的锈蚀,工业上普遍采用的方法是____________(答两种方法)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,下列有关叙述不正确的是( )

A. ③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
D. V1L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类的生活、生产息息相关,下列说法正确的是
A.氯水和食盐水消毒杀菌的原理相同
B.制造普通玻璃的原料为石英砂、石灰石和纯碱
C.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
D.可以用钢瓶储存液氯和浓H2SO4,因为它们对钢瓶发生了钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,相同物质的量浓度的下列溶液中:①NaCl②NaOH③H2SO4④(NH4)2SO4,其中水的电离程度由大到小顺序___(填序号)。
(2)25℃时,体积相同,浓度均为0.2mol·L-1的氨水和NaOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为___;常温下,pH=12的NaOH溶液与pH=2的硫酸,若等体积混合后,溶液的pH为___;
(3)用离子方程式解释碳酸钠溶液呈碱性的原因:___。
(4)能证明CH3COOH是弱酸的事实是___。
A.CH3COOH易挥发
B.常温下,0.1mol·L-1CH3COONa溶液的pH大于7
C.醋酸不易腐蚀衣服
D.pH=3的CH3COOH溶液稀释10倍,溶液pH<4
E.等体积等浓度的CH3COOH溶液和盐酸,分别与足量镁粉反应,产生氢气一样多
F.将一定量的CH3COOH溶液加入Na2CO3溶液中,有气泡产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com