
| A. | ①③④⑤ | B. | ①③⑤ | C. | ①③④⑦ | D. | ①③⑤⑥ |
分析 ①指南针磁针在天然地磁场的作用下可以自由转动并保持在磁子午线的切线方向上;
②火药的主要成分有硫磺、木炭、硝酸钾等物质,其中的木炭是由木材隔绝空气加热制成;
③转轮排字没有新物质生成;
④黏土制陶瓷有新物质生成;
⑤玻璃的成分是二氧化硅;
⑥铝离子水解显酸性;
⑦湿法炼铜有新物质铜生成.
解答 解:①指南针磁针在天然地磁场的作用下可以自由转动并保持在磁子午线的切线方向上,没有新物质生成,不涉及化学反应,故①正确;
②火药的主要成分有硫磺、木炭、硝酸钾等物质,其中的木炭是由木材隔绝空气加热制成,属于化学变化,故②错误;
③转轮排字没有新物质生成,不涉及化学反应,故③正确;
④黏土制陶瓷有新物质生成,涉及化学反应,故④错误;
⑤玻璃的成分是二氧化硅,二氧化硅与酸不反应,没有新物质生成,不涉及化学反应,故⑤正确;
⑥铝离子水解显酸性,氢离子能与铜锈反应,有新物质生成,涉及化学反应,故⑥错误;
⑦湿法炼铜有新物质铜生成,有新物质生成,涉及化学反应,故⑦错误;
故选B.
点评 本考点考查了物理变化和化学变化的区别,基础性比较强,只要抓住关键点:是否有新物质生成,问题就很容易解决.本考点主要出现在选择题和填空题中.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:解答题
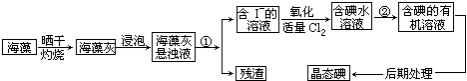
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水、液氯都含有氯气分子,均为混合物 | |
| B. | SiO2与Al2O3都既可以与酸又可以与碱反应,故都是两性氧化物 | |
| C. | 胶体与溶液的分散质粒子均可以通过滤纸 | |
| D. | 氢氟酸可用于刻蚀玻璃,是利用SiO2酸性氧化物的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑤ | C. | ③④⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si、P、S、Cl元素的单质与氢气化合越来越容易 | |
| B. | 非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 | |
| C. | 元素原子最外层电子数越多,元素金属性越强 | |
| D. | F-、O2-、Mg2+、Na+离子半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
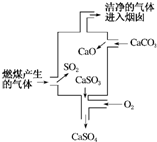
| A. | 使用此装置处理过的废气就不会对大气造成污染了 | |
| B. | 装置内发生的反应有化合、分解、置换和氧化还原反应 | |
| C. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 | |
| D. | 可用澄清的石灰水检验经过处理的废气是否达标 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0Ll.0mol.L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA | |
| C. | 25C时pH=11的Na2C03溶液中水电离出的OH-的数目为0.001NA | |
| D. | 氧原子总数为0.2NA的S02和O2的混合气体,其体积为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,下列可以验证C与D两元素原子得电子能力强弱的事实是BCD(填编号).
,下列可以验证C与D两元素原子得电子能力强弱的事实是BCD(填编号).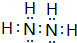 ;C的另一种氢化物与D的一种氢化物的电子总数相等,实验室制取C的该气态氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
;C的另一种氢化物与D的一种氢化物的电子总数相等,实验室制取C的该气态氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com