
【题目】实验室欲用NaOH固体配制1.0mol/L的NaOH溶液240mL.一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤移液 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
(1)配制溶液时,其正确的操作顺序为(填序号).本实验必须用到的仪器有托盘天平、药匙、玻璃棒、烧杯、、 .
(2)某同学欲称量NaOH的质量,先用托盘天平称量烧杯的质量,托盘天平平衡后的状态如图所示.烧杯的实际质量为g,要完成本实验该同学应称量g NaOH. 
(3)使用容量瓶前必须进行的一步操作是 .
(4)配制过程中,下列操作会引起所配溶液浓度偏高的是(填序号).
A.转移溶液时,有少量溶液洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却至室温就将溶液移入容量瓶中并定容
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加蒸馏水至刻度线.
【答案】
(1)②①③⑧⑤⑨⑥⑦④;250mL容量瓶;胶头滴管
(2)27.4;10.0
(3)检查是否漏水
(4)BC
【解析】解:(1)配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,所以正确的操作步骤为:②①③⑧⑤⑨⑥⑦④;需要的仪器:托盘天平、药匙、玻璃棒、烧杯、容量瓶、胶头滴管,配制250mL溶液应选择250mL容量瓶,所以还需要的仪器:250mL容量瓶、胶头滴管;
所以答案是:②①③⑧⑤⑨⑥⑦④;250mL容量瓶;胶头滴管;(2)先看图中称量方式是左码右物,所称物品质量为砝码﹣游码,再据图读数,砝码20、10共30g,游码2.6g,所以烧杯质量为10+20﹣2.6=27.4g;配制1.0mol/L的NaOH溶液240mL,应选择250mL容量瓶,实际配制250mL溶液,需要溶质的质量为:1.0mol/L×0.25L×40g/mol=10.0g;
所以答案是:27.4;10.0;(3)容量瓶带有活塞,使用时需要上下颠倒摇匀,为防止漏液,使用前应检查是否漏水;
所以答案是:检查是否漏水;(4)A.转移溶液时,有少量溶液洒到容量瓶外面,导致溶质的物质的量偏小,溶液浓度偏低,故A不选;
B.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故B选;
C.未冷却至室温就将溶液移入容量瓶中并定容,冷却后溶液体积偏小,溶液浓度偏高,故C选;
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低,故D不选;
故选:BC.
【考点精析】本题主要考查了配制一定物质的量浓度的溶液的相关知识点,需要掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线才能正确解答此题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】200mL0.2molL﹣1和100mL0.5molL﹣1的两种盐酸混合,假设得到300mL盐酸,其物质的量浓度是多少?若所得盐酸的密度为1.004gcm﹣3 , 则其溶质的质量分数是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( ) 
A.Cl2+2KBr═Br2+2KCl
B.2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O═4Fe(OH)3
D.2Na2O2+2CO2═2Na2CO3+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取硫酸铜不是直接利用浓硫酸与铜的反应,而是将铜丝浸入稀硫酸中,并不断从容器下部吹入细小的空气泡,这样做的优点是( )
①节省能源 ②不产生污染大气的SO2 ③提高了H2SO4的利用率 ④提高了Cu的利用率
A. ①② B. ②③④ C. ①②③ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄酮类化合物具有抗肿瘤活性,6-羟基黄酮衍生物的合成路线如下:
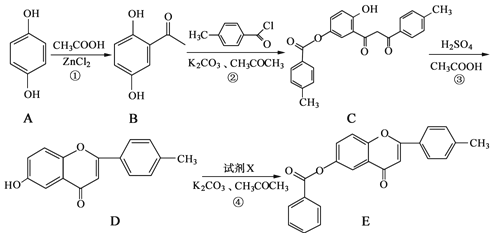
(1)化合物B中的含氧官能团的名称为_____和______。
(2)A→B的反应类型为___________。
(3)反应④中加入的试剂X的分子式为C7H5OCl,X的结构简式为________。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:__________。
①能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应;
②分子中有4种不同化学环境的氢。
(5)已知 请写出以
请写出以![]() 和CH3COOH为原料制备
和CH3COOH为原料制备
的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃、101 kPa时,强酸与强碱的稀溶液中发生中和反应的中和热为57.3 kJ·mol-1,则下列描述正确的是
A. KOH(aq)+![]() H2SO4(aq)===
H2SO4(aq)===![]() K2SO4(aq)+H2O(1) ΔH=-57.3 kJ·mol-1
K2SO4(aq)+H2O(1) ΔH=-57.3 kJ·mol-1
B. NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(1) ΔH=+57.3 kJ·mol-1
C. H2SO4和Ca(OH)2反应的中和热为ΔH=2×(-57.3) kJ·mol-1
D. 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)1.5mol HNO3约含有个氧原子,含0.6mol H 的C6H12O6的物质的量是mol.
(2)22克CO2的物质的量为mol,该气体在标准状况下的体积为L.
(3)4gNaOH固体的物质的量为mol,将其溶于水配成500mL溶液,此溶液中NaOH的物质的量浓度为 .
(4)将5mol/L盐酸10mL稀释到200mL,稀释后溶液的物质的量浓度是 .
(5)实验室制备Fe (OH)3胶体的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com