
【题目】将淀粉浆和淀粉酶的混合物放入半透膜袋中,扎好后浸入流动的温水中,经过足够的时间后,取出袋内的液体,分别与①碘水' ②新制Cu(OH)2悬浊液(加热)' ③浓硝酸(微热)作用,其现象依次是( )
A. 显蓝色;无红色沉淀;显黄色
B. 不显蓝色;无红色沉淀;显黄色
C. 显蓝色;有红色沉淀;不显黄色
D. 不显蓝色;有红色沉淀;不显黄色
 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:
Fe2O3(s)+3CO(s,石墨)═2Fe(s)+3CO2(g)△H1=+489.0kJmol﹣1
C(s,石墨)+CO2(g)═2CO(g)△H2=+172.5kJmol﹣1
则CO还原Fe2O3(s)的热化学方程式为_____。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△H
①取一定体积CO2和H2的混合气体(物质的量之比为1:3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的△H____0(填“>”、“<”或“=”,下同)。
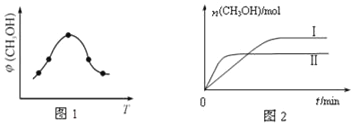
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠ_____KⅡ。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成.开始以氨碳比![]() =3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_____。
=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_____。
②将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10﹣5,碳酸一级电离常数Ka=4.3×10﹣7,则NH4HCO3溶液呈_____(填“酸性”、“中性”或“碱性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32-![]() +H2O→Cu(OH)2↓+CO2↑ 次要:Cu2++ CO32-→CuCO3↓
+H2O→Cu(OH)2↓+CO2↑ 次要:Cu2++ CO32-→CuCO3↓
(2)CuSO4+Na2S
主要:Cu2++S2-→CuS↓ 次要:Cu2++S2-+2H2O→Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是( )
A. Cu(OH)2>CuCO3>CuS B. CuS>Cu(OH)2>CuCO3
C. CuS<Cu(OH)2<CuCO3 D. Cu(OH)2<CuCO3<CuS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法错误的是( )
A. 标准状态下,1LSO3含有的分子数为NA/22.4
B. 17gOH-中含有的电子数为10NA
C. 46g二氧化氮和46g四氧化二氮含有的原子数均为3NA
D. 常温常压下,34gH2O2中含有共用电子对数为3NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
①NaHCO3溶液加水稀释时,![]() 将增大;
将增大;
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO![]() )+c(HCO)];
)+c(HCO)];
③在0.1 mol·L-1氨水中滴加0.1 mol·L-1盐酸,恰好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol·L-1;
④已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2Cr2O4的溶解度小于AgCl
A. ①② B. ②④ C. ① D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种主族元素的原子序数依次增大,且均小于18.A原子的最外层电子比B原子的最外层电子少2个,B原子的质子数是其电子层数的4倍.A、B、C三种元素能结合成化合物C2AB3 , 在1mol C2AB3中共有52mol电子.D元素的单质0.5mol与酸全部反应生时,有9.03×1023个电子转移.E元素的单质是一种黄绿色气体,水溶液具有漂白性.试填写下列空白:
(1)写出元素A和E的名称:A , E .
(2)元素B在周期表中的位置为第二周期族.
(3)由元素B、C形成的一种化合物可以作为呼吸面具的供氧剂,该化合物为含有键(填“极性”或“非极性”)的化合物(填“离子”或“共价”),写出该化合物的电子式 .
(4)写出C、D两种元素对应的最高价氧化物的水化物相互反应的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com