
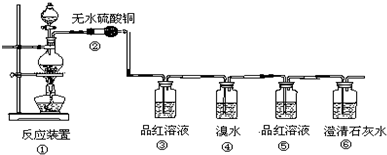
 硫代硫酸钠(Na2S2O3)是一种重要的化工产品,它受热,遇酸易分解,向Na2CO3和Na2S混合物中通入SO2可制得Na2S2O3,某兴趣小组用如图1实验装置制备硫代硫酸钠晶体(Na2S2O3•5H2O),回答下列问题:
硫代硫酸钠(Na2S2O3)是一种重要的化工产品,它受热,遇酸易分解,向Na2CO3和Na2S混合物中通入SO2可制得Na2S2O3,某兴趣小组用如图1实验装置制备硫代硫酸钠晶体(Na2S2O3•5H2O),回答下列问题:分析 (1)仪器a的名称是分液漏斗;b中生成二氧化硫,利用硫酸与亚硫酸钠反应制备二氧化硫,c中得到硫代硫酸钠,由题目信息可知,c中盛放Na2CO3和Na2S混合物,发生总反应为:Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2;
(2)二氧化硫与硫化钠在溶液中反应得到S,硫与亚硫酸钠反应得到Na2S2O3;
(3)d装置目的是吸收剩余的二氧化硫,防止污染空气,可以用氢氧化钠溶液吸收;
(4)由题目信息可知,硫代硫酸钠(Na2S2O3)遇酸易分解,而二氧化硫过量会使溶液呈酸性;
(5)①Na2S2O3反应完毕,加入最后一滴碘的标准液遇淀粉变蓝色;
②起始、终点时标准液读数之差消耗标准液的体积;根据方程式计算Na2S2O3的物质的量,再根据m=nM计算其质量,进而计算产品的纯度.
解答 解:(1)仪器a的名称是分液漏斗;b中生成二氧化硫,利用硫酸与亚硫酸钠反应制备二氧化硫,b中盛放试剂为Na2SO3;c中得到硫代硫酸钠,由题目信息可知,c中盛放Na2CO3和Na2S混合物,发生总反应为:Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2,
故答案为:分液漏斗;Na2SO3;Na2CO3和Na2S混合物;
(2)二氧化硫与硫化钠在溶液中反应得到S,硫与亚硫酸钠反应得到Na2S2O3,c中先有浑浊产生,后又变澄清,此浑浊物为S,
故答案为:S;
(3)d装置目的是吸收剩余的二氧化硫,防止污染空气,可以用氢氧化钠溶液吸收,
故答案为:NaOH溶液;
(4)由题目信息可知,硫代硫酸钠(Na2S2O3)遇酸易分解,若二氧化硫过量会使溶液呈酸性,故实验中通入的SO2不能过量,防止硫代硫酸钠分解,
故答案为:若二氧化硫过量会使溶液呈酸性,使硫代硫酸钠发生分解;
(5)①Na2S2O3反应完毕,加入最后一滴碘的标准液遇淀粉变蓝色,滴定至终点时,溶液颜色的变化是:溶液由无色变为蓝色,
故答案为:溶液由无色变为蓝色;
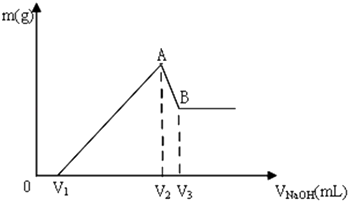
②由图可知,开始液面读数为0.00mL,滴定终点液面读数为18.10mL,则消耗标准液的体积为18.10mL,由2S2O32-+I2=S2O32-+2I-可知n(Na2S2O3)=2n(I2)=2×18.10×10-3L×0.1mol/L=)=3.62×10-3mol,故样品的纯度为$\frac{3.62×1{0}^{-3}mol×Mg/mol}{Wg}$×100%=$\frac{3.62×1{0}^{-3}M}{W}$×100%,
故答案为:$\frac{3.62×1{0}^{-3}M}{W}$×100%.
点评 本题考查实验制备方案、物质含量的测定,明确原理是解题关键,注意对题目信息的提取应用,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )| A. | 能与FeCl3 溶液发生显色反应 | |
| B. | 能使酸性KMnO4 溶液褪色 | |
| C. | 能发生加成、取代,不能消去反应 | |
| D. | 1 mol 该物质最多可与1 mol NaOH 反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着原子序数的递增,第三周期元素的电负性逐渐减小 | |
| B. | 铝的第一电离能比镁的第一电离能大 | |
| C. | K、Na、Li的第一电离能逐渐增大 | |
| D. | 电负性差值大的元素原子之间形成的化学键主要是共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠在空气中加热,生成淡黄色固体:2Na+O2═Na2O2 | |
| B. | 向硫酸铝溶液中加入氨水制备氢氧化铝:Al3++3NH3•H2O=Al(OH)3↓+3$N{{H}_{4}}^{+}$ | |
| C. | 铁在潮湿的环境中生锈:3Fe+4H2O=Fe3O4+H2↑ | |
| D. | 二氧化氮溶于水有硝酸生成:3NO2+H2O=2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①、④溶液中水电离的c( H+):①>④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②<③ | |
| C. | 分别向等体积的上述溶液中加入100 ml,水,溶液的pH:③>④>①>② | |
| D. | 将①、④溶液混合后pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 三氯生的分子式为:C12H6Cl3O2 | |
| B. | 三氯甲烷只有一种结构,可推知CH4是正四面体 | |
| C. | 三氯生能与NaOH溶液反应 | |
| D. | 常温下,三氯生易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com