
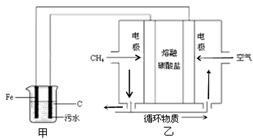
| A.为了增加污水的导电能力,可向污水中如入适量的Na2SO4固体 |
| B.甲装置中Fe电极的反应为Fe-3e-=Fe3+ |
| C.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环物质为H2O |
| D.当乙装置中有1.6gCH4参加反应,则C电极理论上生成气体在标准状况下为8.96L |


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源:不详 题型:单选题
 。下列叙述正确的是( )
。下列叙述正确的是( )A.放电时C 向正极移动 向正极移动 |
| B.放电时OH-向负极移动 |
C.负极反应为H2+C -2e-=H2O+CO2 -2e-=H2O+CO2 |
| D.当该电池产生的水蒸气折算成标准状况下的体积为22.4 L时,转移电子4 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.电池总反应为:4NH3 + 3O2 = N2 + 6H2O |
| B.电池工作时,OH-向负极移动 |
| C.电极2发生的电极反应为:O2+4H+ + 4e-=2H2O |
| D.电流由电极1经外电路流向电极2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
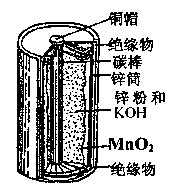
| A.MnO2是氧化剂,被氧化 |
| B.碳棒为负极、锌筒为正极 |
| C.放电过程中NH4+向锌极移动 |
| D.负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ,分别在U形管两端小心倒入饱和食盐水和饱和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述错误的是
,分别在U形管两端小心倒入饱和食盐水和饱和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述错误的是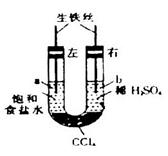
A.铁丝在两处的腐蚀速率: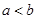 |
B.a、b两处相同的电极反应式为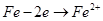 |
| C.一段时间后,a处液面高于b处液面 |
| D.生铁丝中的碳在a、b两处分别作原电池的负极和正极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电池总反应为Mg+H2O2 = Mg(OH)2 |
| B.正极发生的电极反应为H2O2+2H++2e- = 2H2O |
| C.工作时,正极周围海水的pH减小 |
| D.电池工作时,溶液中的H+向负极移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.燃料电池的负极反应物是氢气、甲烷、乙醇等物质 |
| B.氢氧燃料电池常用于航天飞行器,产物水经过处理之后可供宇航员使用 |
| C.H2SO4作电解质,氢氧燃料电池的负极反应式H2+2OH--2e-=2H2O |
| D.乙醇燃料电池电解质为KOH,负极反应式C2H5OH+16OH--12e-=2CO32-+11H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.铜是阳极,铜片上有气泡产生 |
| B.盐桥中的K+ 移向ZnSO4溶液 |
| C.电流从锌片经导线流向铜片 |
| D.铜离子在铜片表面被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2+H2O+2e—→Mn2O3+2OH— |
| C.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g[ |
| D.电池工作时,电子由负极通过电解液流向正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com