
下列有关实验原理或实验操作正确的是
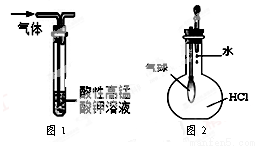
A.用干燥pH试纸测定某新制氯水的pH
B.用图1装置能除去SO2中混有的CO2
C.用图2装置能验证HCl气体在水中的溶解性
D.用25 mL碱式滴定管量取20.00 mLKMnO4溶液
科目:高中化学 来源:2014高考名师推荐化学无机物性质及应用(金属)(解析版) 题型:选择题
下列说法正确的是
A.铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应
B.硅在电子工业中是最重要的半导体材料,广泛用于制作光导纤维
C.二氧化硫是一种有毒气体,所以不能用于杀菌消毒
D.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学常见有机物性质与结构(解析版) 题型:选择题
香叶醇是合成玫瑰香油的主要原料,其结构简式如下,下列有关香叶醇的叙述正确的是
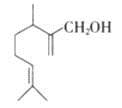
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能发生加成反应不能发生取代反应
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学工业流程图分析(解析版) 题型:填空题
氯气是重要的化工原料。
(1)氯气溶于水得到氯水,氯水中存在下列反应:Cl2 + H2O H++Cl-+ HClO,其平衡常数表达式为K= 。
H++Cl-+ HClO,其平衡常数表达式为K= 。
(2)工业上常用熟石灰和氯气反应制取漂白粉,化学反应方程式是 。流程如下图所示,其主要设备是氯化塔,塔从上到下分四层。

将含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入。这样加料的目的是 ,处理从氯化塔中逸出气体的方法是 。
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是 ,其原因可能是 ,由此可知(2)中氯化塔设计为四层是为了减少生产中类似副反应的发生。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学工业流程图分析(解析版) 题型:填空题
氯碱工业中电解饱和食盐水的原理示意图如下图所示:

(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 ;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42->c(Ca2+)]。精致流程如下(淡盐水和溶液A来自电解池):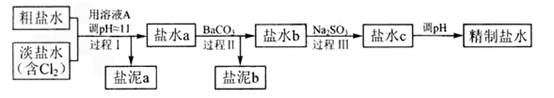
①盐泥a除泥沙外,还含有的物质是 。
②过程Ⅰ中将NH4+转化为N2的离子方程式是 。 ③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验药品保存、基本操作、检验(解析版) 题型:选择题
下列实验操作中错误的是
A.用酒精萃取碘水中的碘
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.过滤时玻璃棒的末端应轻轻靠在三层的滤纸上
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验专题(解析版) 题型:填空题
碳酸钠俗称纯碱,其用途很广。实验室中,用碳酸氢铵和饱和食盐水可制得纯碱。各物质在不同温度下的溶解度见表。
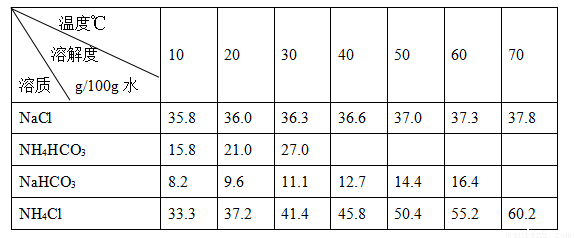
实验步骤
Ⅰ、化盐与精制:①粗盐(含Ca2+、Mg2+、SO42-)溶解;②加入足量NaOH和Na2CO3溶液,煮沸;③过滤;④加入盐酸调pH至7。
Ⅱ、转化:①将精制后的食盐溶液温度控制在30~35℃之间;在不断搅拌下,加入研细的碳酸氢铵;保温,搅拌半小时;②静置,a 、b ;③得到NaHCO3晶体。
Ⅲ、制纯碱:将得的NaHCO3放入蒸发皿中,在酒精灯上灼烧,冷却到室温,即得到纯碱。
完成下列填空:
(1)“化盐与精制”可除去的粗盐中的杂质离子是 。
(2)“转化”的离子方程式是 。
(3)“转化”过程中,温度控制在30~35℃之间的加热方式是 ;为什么温度控制在30~35℃之间? 。
(4)a、b处的操作分别是 、 。
(5)实验室制得的纯碱含少量NaCl还可能含少量NaHCO3,为测定纯碱的纯度,用电子天平准确称取样品G克,将其放入锥形瓶中用适量蒸馏水溶解,滴加2滴酚酞,用c mol/L的标准盐酸滴定至溶液由浅红色变成无色且半分钟不变,滴定过程中无气体产生,所用盐酸的体积为V1mL。此时发生的反应为:
CO32-+H+→HCO3-
①样品中碳酸钠质量百分含量的表达式是 。
②向锥形瓶溶液中继续滴加2滴甲基橙,用同浓度的盐酸继续滴定至终点,所用盐酸的体积为V2mL。滴定终点时溶液颜色的变化是 ;根据实验数据,如何判断样品含NaHCO3 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学守恒及离子浓度大小的比较(解析版) 题型:选择题
下列有关物质浓度关系的描述,正确的是
A.25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1
B.25 ℃时,向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(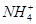 )>c(
)>c(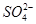 )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
C.0.1 mol·L-1NaHCO3溶液中:c(OH-)+2c(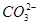 )=c(H+)+c(H2CO3)
)=c(H+)+c(H2CO3)
D.同温下,pH相同时,溶液物质的量浓度:
c(CH3COONa)> c(Na2CO3)>c(C6H5ONa)>c(NaHCO3)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学原电池的工作原理、电极反应式的书写(解析版) 题型:选择题
肼(N2H4)—空气燃料电池是一种环保型碱性燃料电池,电解质为20%~30%的KOH溶液,电池总反应为N2H4+O2=N2+2H2O。下列关于该电池工作时说法中正确的是
A.正极的电极反应式:O2+4H++4e-=2H2O
B.溶液中的阴离子向正极移动
C.负极的电极反应式:N2H4+4OH--4e-=4H2O+N2
D.溶液的pH保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com