
【题目】下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| 选项 | a | b | c |
A | Al | AlCl3 | Al(OH)3 | |
B | CO2 | Na2CO3 | NaHCO3 | |
C | Si | SiO2 | H2SiO3 | |
D | S | SO3 | H2SO4 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】下列图像中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是
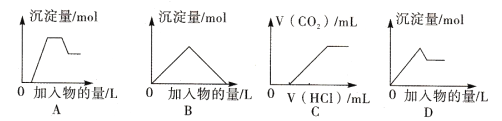
A. 图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀量的关系曲线
B. 图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C. 图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线
D. 图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含碳原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,可逆反应mA(g) + nB(g) ![]() pC(g) + qD(g)的平衡常数为K,下列说法正确的是( )
pC(g) + qD(g)的平衡常数为K,下列说法正确的是( )
A. K值越小,达到平衡时,反应物的转化率越大
B. K值越大,达到平衡时,生成物的含量越大
C. 反应物的转化率越大,达到平衡时,K值越大
D. 温度越高,达到平衡时,K值越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X2(g)+Y2(g)![]() 2Z(g),已知的起始浓度分别为0.1mol/L、0.3 mol/L、 0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度可能是( )
2Z(g),已知的起始浓度分别为0.1mol/L、0.3 mol/L、 0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度可能是( )
A. c(Z)=0.3 mol/L B. c(X2)=0.2mol/L、
C. c(Y2)=0.4 mol/L D. c(X2)+ c(Y2) +c(Z)=0.55 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是生命的基础,自然界中氮的循环过程如下图所示,请分析此图并回答有关问题。

(1)大气中的氮以________(填化学式)形式存在,图中共表示了_______种固氮的途径。
(2)由图可知,动植物体内的氮主要存在于蛋白质中,当动植物尸体发生腐败时,往往会产生一种含氮的气体,其电子式为________。
(3)土壤中的硝酸盐会被细菌分解。有一种脱氧硫杆菌能够利用土壤中的硫化物来分解硝酸盐,其主要化学原理如下:K2S+KNO3+H2O![]() N2↑+K2SO4+KOH,配平上述反应方程式,并标出电子转移的方向和数目___________。上述反应的氧化剂是_____,被氧化的元素是______。
N2↑+K2SO4+KOH,配平上述反应方程式,并标出电子转移的方向和数目___________。上述反应的氧化剂是_____,被氧化的元素是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘可用作心脏起搏器电源——锂碘电池的材料。该电池反应为:2Li+I2=2LiI,下列说法正确的是( )
A.Li做负极,被还原B.I2做正极,被氧化
C.H2O作电解质D.电子由Li电极流出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.5 molL -1 盐酸与50 mL0.55 mol L -1 NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________。
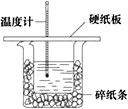
(2)烧杯间填满碎纸条的作用是______________________________________。
(3)若大烧杯上不盖硬纸板,求得中和热数值_______(填“偏大”“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 molL -1 盐酸跟50 mL 0.55 molL -1 NaOH溶液进行反应,与上述实验相比,所放出的热量 _______(填“相等”或“不相等”),所求中和热 _____(填“相等”或“不相等”),简述理由_______________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会_________;用0.50 molL -1 NaOH溶液50 mL进行上述实验,测得的中和热的数值会__________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列说法正确的是( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com