
【题目】下列物质的变化,不能通过一步化学反应完成的是( )
A.Na2O2→Na2CO3B.Fe→FeCl2C.SiO2→H2SiO3D.Na2CO3→NaHCO3
科目:高中化学 来源: 题型:
【题目】为了减少大气污染,许多城市推广汽车使用清洁燃料,目前使用的清洁燃料主要有两类:一类是压缩天然气,另一类是液化石油气。这两类燃料的主要成分都是 ( )
A. 碳水化合物 B. 碳氢化合物 C. 氢气 D. 水煤气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸的工业生产可以采用生物发酵法,也可以采用有机合成法,其中的一种方法是丙酸法。
Ⅰ.生物发酵法
![]()
(1)检验淀粉是否完全水解,可以选用的一种试剂是__________(填序号)。
a.溴水 b.银氨溶液 c.碘酒 d.碘化钾淀粉溶液
(2)已知葡萄糖在乳酸菌作用下可转化为乳酸(C3H6O3)。
①写出葡萄糖与银氨溶液反应,再酸化的有机产物的结构简式:___________________。
②乳酸在Cu作催化剂时可被氧化成丙酮酸(![]() ),由以上事实推知乳酸的结构简式为_______。
),由以上事实推知乳酸的结构简式为_______。
③乳酸在一定条件下反应生成高分子化合物的化学方程式为__________________________________
④乳酸在浓H2SO4加热条件下可以生成一种能使溴水褪色的有机物A。 A在一定条件下可以合成一种常见的有机高分子化合物B,B的结构简式为____________________________。
Ⅱ.丙酸合成法

(3)反应I的反应类型是________,进行反应Ⅱ时,需要加入过量乙醇,这样做的目的是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
已知:①![]()
②![]()
回答下列问题:
(1)A的结构简式是__________。
(2)由B转化为C的过程中反应(1)的化学方程式为___________________________
(3)由D生成E和E生成F的反应类型分别是__________、_________。
(4)E的结构简式为____________。
(5)G为甲苯的同分异构体,G分子的一氯代物有 ___________种。
(6)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有5种不同化学环境的氢,峰面积比为4∶2∶2∶1∶1,写出2种符合要求的X的结构简式__________________、________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如下:
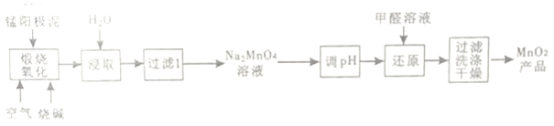
(1)“煅烧氧化”时,1mol MnO煅烧完全转化为Na2MnO4失去电子的物质的量为___________;MnO2煅烧反应的化学方程式为__________________。
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有____________、____________(列举2点)
(3)“调pH”是将溶液pH 调至约为10,防止pH较低时Na2MnO4自身发生氧化还原反应,生成MnO2和___________;写出用pH试纸测定溶液pH的操作_______________。
(4)“还原”时有无机含氧酸盐生成,发生反应的化学方程式为_____________。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1. 准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2. 然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是_____________;产品中MnO2的质量分数为ω(MnO2)=____________(列出计算的表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 阿伏加德罗常数是12g碳中所含有的碳原子数
B. 已知微粒个数,可通过阿伏加德罗常数计算出微粒的物质的量
C. 阿伏加德罗常数的数值是6.02×1023
D. 阿伏加德罗常数的符号为NA,通常用6.02×1023表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组为了探究SO2的性质,设计了如下装置,

实验步骤:
①先连接好装置,检查气密性,再加入试剂;
②加热A试管;
③将铜丝向上抽动离开液面。
(1)A试管中发生反应的化学方程式是______。
(2)B试管中的现象是______。
(3)试管C无明显现象,某小组取一部分反应后的溶液,分别滴加以下试剂,请你预测能否生成沉淀,若生成沉淀,写出生成沉淀的化学式。
加入试剂 | 能否生成沉淀 | 沉淀的化学式 |
氯水 | _____________ | __________ |
氨水 | __________ | ___________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=0的某X溶液中,除H+外,还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量X溶液进行如下一系列实验:

下列有关判断不正确的是( )
A. 生成气体A的离子方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
B. 生成沉淀H的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
C. 溶液X中一定没有的离子仅为:CO32-、Ba2+
D. 溶液X中一定含有的离子是:H+、Fe2+、SO42-、NH4+、Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com