
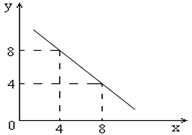
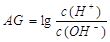 。则该温度下,0.01mol/L盐酸的酸度AG= 。
。则该温度下,0.01mol/L盐酸的酸度AG= 。 科目:高中化学 来源:不详 题型:单选题
| A.两清夜混合,AgCl和AgI都沉淀。 |
| B.向AgCl清夜加入AgNO3固体,c(Ag+)增大,Ksp(AgCl)也增大 |
| C.若AgNO3固体足量,AgCl和AgI都可沉淀,但以AgCl沉淀为主 |
| D.若取0.235克AgI固体放入100ml(忽略体积变化),c(I-)=0.01mol/l |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 mol/L H2SO4溶液 | B.2 mol/L Na2SO4溶液 |
| C.0.1 mol/L BaCl2溶液 | D.纯水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比 |
| B.K2S溶液中c(K+)与c(S2-)之比 |
| C.相同温度下0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中的c(H+)之比 |
| D.10mL0.5mol/L的盐酸与5mL0.5mol/L的盐酸溶液中的c(H+)之比 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgCl>AgI> Ag2CrO4 | B.AgCl> Ag2CrO4>AgI |
| C.Ag2CrO4>AgCl>AgI | D.Ag2CrO4>AgI>AgCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgCl不溶于水,不能转化为AgI |
| B.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 |
| C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必不低于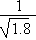 ×10-11 mol·L-1 ×10-11 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.温度一定时,当溶液中c(Ba2+)×c(SO42-)=1.07×10-10时,此溶液为BaSO4的饱和 溶液 |
| B.因为Ksp(BaCO3)>Ksp(BaSO4),所以无法将BaSO4转化为BaCO3 |
| C.25 ℃ 时,在未溶解完BaCO3的饱和溶液中滴入少量Na2SO4溶液后有BaSO4沉淀析 出,此时溶液中c(CO32-)∶c(SO42-)=24.11 |
| D.在饱和BaCO3溶液中加入少量Na2CO3固体,可使c(Ba2+)减小,BaCO3的溶度积不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
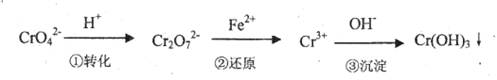
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
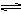 Ag+ + Cl-,平衡时,c(Ag+)·c(C-)="Ksp" ,过量氯化银分别投入①100 mL水 ②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中c(Ag+)大小顺序为
Ag+ + Cl-,平衡时,c(Ag+)·c(C-)="Ksp" ,过量氯化银分别投入①100 mL水 ②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中c(Ag+)大小顺序为| A.③①②④ | B.④①②③ | C.①②③④ | D.④③②① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com