
| A、硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ |
| B、大理石投入稀硝酸:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、铜片插入硝酸银溶液中:Cu2++Ag+=Cu2++Ag |
| D、澄清石灰水中加入盐酸:Ca(OH)2+2H+═Ca2++2H2O |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、0.1molNaOD溶于重水制成1L溶液,pD=13 |
| B、将pD=4的DCl的重水溶液稀释100倍,所得溶液pD=6 |
| C、向30mL0.5mol?L-1NaOD的重水溶液中加入20mL0.5mol?L-1DCl的重水溶液,所得溶液pD=13 |
| D、pD=10的NaOD的重水溶液中,由重水电离出的c(OD-)为1×10-10mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.0g重水(2H2O)中含有的质子数为1.0 NA |
| B、0.1mol丙烯酸中含有双键的数目为0.1NA |
| C、标准状况下,11.2 LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为NA |
| D、标准状况下,2.24L苯中含有的C-H键的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大理石与盐酸反应:CO32-+2H+═H2O+CO2↑ |
| B、铁粉与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| C、氯化镁溶液中滴入氢氧化钠溶液:MgCl2+2OH-═Mg(OH)2↓+2Cl- |
| D、氯化钡溶液与稀硫酸混合:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物 |
| B、HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 |
| C、HF、CH3CH2OH、KOH都易溶于水,都是电解质 |
| D、HCOOH、H2CO3、H2S分子中均含有两个氢原子,都是二元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
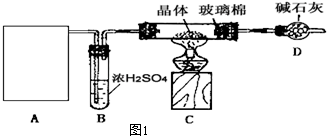

| 硬质玻璃管质量 | 硬质玻璃管与晶体总质量 | 加热后硬质玻璃管与固体 总质量 | 反应前后D的质量 | ||
| 第一次称量 | 第二次称量 | 反应前 | 反应后 | ||
| 82.112g | 85.097g | 84.028g | Wg | 78.368g | 80.474g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com