
下列说法正确的是
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO )+c(HCO
)+c(HCO )]
)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时pH=a,则由水电离产生的
c(OH-)=l0-amol·L-1
④已知:Ksp(AgCl)=1.8xl0-10, Ksp(A92Cr2O4)=2.0×l0-12,则Ag2CrO4的溶解度小于AgCl
A.①④ B.②③ C.①③ D.②④
科目:高中化学 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:选择题
25 ℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如图所示。
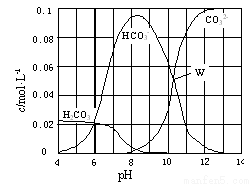
下列有关溶液中离子浓度关系叙述正确的是 ( )
A.W点所示的溶液中:c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-)
B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)<0.1 mol·L-1
C.pH=8的溶液中:c(H+)+ c(H2CO3)+ c(HCO3-) = c(OH-)+c(Cl-)
D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省高二上学期期末考试化学试卷(解析版) 题型:选择题
已知:CaC2O4沉淀的Ksp=2.3×10-9 ,将等体积的CaCl2溶液与Na2C2O4溶液混合,若起始CaCl2的浓度为1×10-2mo1·L-1 ,则生成沉淀所需Na2C2O4溶液的最小起始浓度为
A.2. 3×10-7mol·L-1 B.4. 6×10-7mol·L-1
C.9. 2×10-7mol·L-1 D. ×10-3mol·L-1
×10-3mol·L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省商丘市高三第三次模拟考试理综化学试卷(解析版) 题型:简答题
(16分)I、用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+ CO2(g)+2H2O(g) △H= -574 kJ·mol-l
②CH4(g)+4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H= -1160 kJ·mol-l
③H2O(g)=H2O(1) △H=-44.0 kJ·mol-l
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式____ 。
II、开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物赢接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)-CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(a)与温度、压强的关系如图所示。

①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=____ ;
②若A、C两点都表示达到的平衡状态,则白反应开始到达平衡状态所需的时间tA tC(填 “>”、“<”或“=”)。
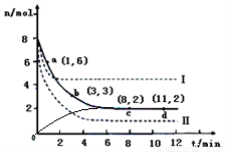
(2)日前工业上也可以用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
①若改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变可能是 ,曲线II对应的实验条件改变可能是____ 。
②请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
III、用MnO2制KMnO4的工艺流程如图:电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4。

①写出240℃熔融时发生反应的化学方程式 ,投料时必须满足n(KOH):n(MnO2) 。
②阳极的电极反应为 。
③B物质是 (填化学式),可以循环使用的物质是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期期末考试化学试卷(解析版) 题型:填空题
海水的综合利用可以制备金属镁,其流程如下图所示:

提示:①MgCl2晶体的化学式为MgCl2·6H2O;
②MgO的熔点为2852oC,无水MgCl2的熔点为714oC。
(1)操作②的名称是________、________、过滤。
(2)试剂a的名称是_______________________。
(3)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤_____________________________
_________________________________________________________________________。
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是_______________________________。
(5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明下列情况下使用玻璃棒的目的;
过滤时:__________________________、蒸发时:________________________
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期期末考试化学试卷(解析版) 题型:选择题
短周期元素E的氯化物ECln的熔点为-78℃,沸点为59℃;若0.2molECln与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀。下列判断错误的是
A.E是一种非金属元素 B.在ECln中E与Cl之间形成共价键
C.E的一种常见氧化物为EO D.E位于元素周期表的ⅥA族
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高二下学期6月联考化学试卷(解析版) 题型:填空题
活性氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1-100纳米。某化工冶金研究所采用湿化学法(NPP-法)制备纳米级活性氧化锌,可用各种含锌物料为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙解获得活性氧化锌,化学工艺流程如下:
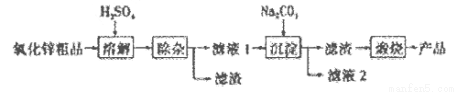
(1)通过__________(填操作名称)可以检验流程中滤液2中含有Na+。
(2)若上述流程图中Na2CO3溶液的pH=12,下列说法正确的是___________。
A该溶液中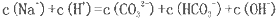
B.该溶液中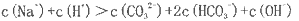
C.该溶液中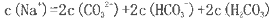
D.若将该溶液稀释至100倍,则pH=10。
(3)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质。取0.5L该溶液先加入___________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0 009 mol/L,则该溶液中至少应加入_______molKMnO4 .
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期5月联考化学试卷(解析版) 题型:实验题
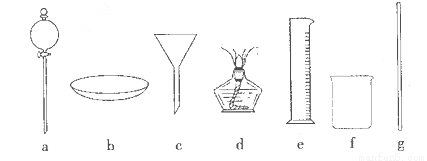
(14分)某研究性学习小组设计实验制各乙酸乙酯(如图1):

(1)制取乙酸乙酯化学方程式为:____________________.
(2)实验过程中,用酒精灯缓慢加热,“缓慢加热”目的是
(3)烧瓶B中加几块碎石片,其作用是__________。长导管L的作用是
(4)图1方案有明显缺陷,请提出改进建议:____________________.
经改进后,实验现象是______________________________.
简述分离乙酸乙酯的操作方法:___________________,需要用到的下列仪器有__________(填代号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com