
 2BO3(g);△H=-196.6kJ/mol
2BO3(g);△H=-196.6kJ/mol HS-+OH-;2H++2e-=H2↑;
HS-+OH-;2H++2e-=H2↑; HS-+OH-;用石墨做电极电解该化合物的水溶液,由于放电能力H+>Na+,所以在阴极是H+得到电子。该电极的反应式为2H++2e-=H2↑;(3)Na2O2与CO2反应的化学方程式是2Na2O2+2CO2 =Na2CO3+ O2 ;在该反应中氧化剂、还原剂都是Na2O2。①×2+②足量可得BO3(g)="3/2" O2(g)+ B(s) ΔH=+395.1KJ/mol.
HS-+OH-;用石墨做电极电解该化合物的水溶液,由于放电能力H+>Na+,所以在阴极是H+得到电子。该电极的反应式为2H++2e-=H2↑;(3)Na2O2与CO2反应的化学方程式是2Na2O2+2CO2 =Na2CO3+ O2 ;在该反应中氧化剂、还原剂都是Na2O2。①×2+②足量可得BO3(g)="3/2" O2(g)+ B(s) ΔH=+395.1KJ/mol.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:不详 题型:单选题
| A.pH=7,溶液呈中性 |
| B.pH<7,溶液呈酸性 |
| C.pH=6,溶液中c(OH-)=1×10-8mol-1 |
| D.pH=6,溶液中c(H+)=1×10-6mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在0.1 mol·L-1Na2S溶液中:2c(Na+) =c(S2-)+c(HS-) +c(H2S) |
| B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+ c(H+)= c(OH-)+c(CH3COO-) |
| C.向0.1 mol·L-1盐酸与0.1 mol·L-1K2CO3溶液等体积混合: c(K+) >c(Cl-)>c(HCO3-)>c(OH-)>c(H+) |
| D.向0.1 mol·L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
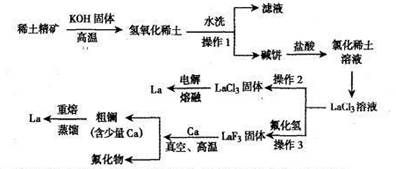
| 金属 | 熔点(℃) | 沸点(℃) |
| 钙 | 841 | 1487 |
| 镧 | 920 | 3470 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(Na+)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(HC2O4) |
B.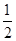 c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-) c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-) |
| C.c(Cl-)=c(HC2O4-)+2c(C2O42-)+c(HC2O4) |
| D.加水稀释时,溶液中c(OH-)增大,其余离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 将少量Fe(NO3)2试样加水溶解,滴加稀H2SO4酸化,再滴加KSCN溶液 | 溶液变成红色 | Fe(NO3)2试样已变质 |
| B | 将少量某无色气体通入澄清石灰水 | 出现白色沉淀 | 该气体一定是CO2 |
| C | 分别测定常温下0.1 mol·L-1 Na2SiO3溶液和Na2CO3溶液的pH | pH:Na2SiO3> Na2CO3 | 非金属性:Si>C |
| D | 向浓度均为0.1 mol·L-1 NaCl和NaI混合溶液中,滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
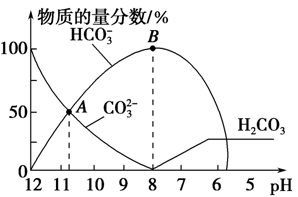
| A.在0.1 mol·L-1 Na2CO3溶液中:c(Na+)+ c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| B.当溶液的pH为7时,溶液的总体积为20 ml |
| C.在B点所示的溶液中,浓度最大的阳离子是Na+ |
| D.在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1 |
B.25 ℃时,向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(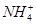 )>c( )>c(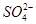 )>c(OH-)=c(H+) )>c(OH-)=c(H+) |
C.0.1 mol·L-1NaHCO3溶液中:c(OH-)+2c(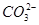 )=c(H+)+c(H2CO3) )=c(H+)+c(H2CO3) |
| D.同温下,pH相同时,溶液物质的量浓度: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com