
����Ŀ��ij�¶��£��ܱ������з������¿��淴Ӧ��2E(g)![]() F(g)��xG(g) ��H<0������ʼʱE��Ũ��Ϊa mol��L1��F��G��Ũ�Ⱦ�Ϊ0���ﵽƽ��ʱE��Ũ��Ϊ0.5a mol��L1����E����ʼŨ��Ϊ2a mol��L1��F��GŨ����Ϊ0�����ﵽ�µ�ƽ��ʱ������˵����ȷ����
F(g)��xG(g) ��H<0������ʼʱE��Ũ��Ϊa mol��L1��F��G��Ũ�Ⱦ�Ϊ0���ﵽƽ��ʱE��Ũ��Ϊ0.5a mol��L1����E����ʼŨ��Ϊ2a mol��L1��F��GŨ����Ϊ0�����ﵽ�µ�ƽ��ʱ������˵����ȷ����
A�������¶�ʱ������Ӧ���ʼӿ죬�淴Ӧ���ʼ���
B����x��1������������ֲ��䣬��ƽ����E���������Ϊ50%
C����x��2������������ֲ��䣬��ƽ����F��ƽ��Ũ��Ϊ0.5a mol��L1
D����x��3������ѹǿ���ֲ��䣬��ƽ����E�����ʵ���Ϊa mol
���𰸡�B
�������������¶�ʱ�������淴Ӧ���ʶ��ӿ죬��A�����B���x=1����Ӧǰ��������䣬�������������������ƽ���ǵ�Ч�ģ�����ͬ�ɷֵİٷֺ�������ͬ����B��ȷ��C���x=2����Ӧ���������Ŀ��淴Ӧ����E����ʼŨ�ȸ�Ϊ2a mol��L-1���൱������ѹǿ��ƽ�����淴Ӧ�����ƶ���������ƽ����F��ƽ��Ũ��С��0.5a mol��L-1����C����֪�������������������E�����ʵ�������D����


 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����(����)
A������ʽ��ͬ����Ԫ����������Ҳ��ͬ��������ͬ������
B��ͨʽ��ͬ�IJ�ͬ����һ������ͬϵ��
C������ʽ��ͬ�IJ�ͬ����һ����ͬ���칹��
D����Է���������ͬ�IJ�ͬ����һ����ͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʹ0.1mol/L��NaHCO3��Һ��c��H+����c��CO32������c��HCO3���������٣��䷽���ǣ� ��
A.ͨ�������̼����
B.�����������ƹ���
C.ͨ���Ȼ�������
D.���뱥��ʯ��ˮ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ������ڹ�ũҵ������������������Ҫ���á�
��1�������Ĵ��������ǹ�ҵ�����������Ҫ���衣ij��ѧ����С�����������װ��ģ���ʵ����̣�����ˮ������ȡ����(�̶�װ����ȥ)��
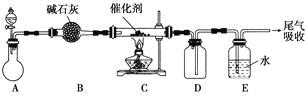
��Aװ�õķ�Һ©����ʢ��Ũ��ˮ������ƿ��ʢ�ŵ�ҩƷӦ����________��
��Cװ���з�����Ӧ�Ļ�ѧ����ʽΪ________________��
�۷�Ӧ��װ��E�г����ڽ϶��H���⣬�����ܴ��ڵ�һ��������________�������ʵ��֤���������ӵĴ���_____________________��
��������Щװ�ÿ���ͬʱ��װ��D��E������________(�����)��
��2�����������Ͱ����ڼ���ƿ�л�ϣ������Ũ��İ��̲��������ڱ����ᣬ��һ�������ǿ�������Ҫ�ɷ�֮һ����д����Ӧ�Ļ�ѧ����ʽ��________________(������ƽ)���÷�Ӧ���ɵĻ�ԭ����Ļ�ѧ��������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���º����ܱ������У��������·�Ӧ��2A��g��+B��g��![]() 3C��g��+D��s��������˵���ܱ����÷�Ӧ�Ѵﵽƽ��״̬����
3C��g��+D��s��������˵���ܱ����÷�Ӧ�Ѵﵽƽ��״̬����
A����������ƽ����Է����������ٸı�
B������������������ʵ�������ʱ����仯
C��D��Ũ�Ȳ���ʱ��仯���ı�
D����λʱ��������2n mol A��ͬʱ������n mol��B
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Դ������ֱ�ӻ�������̫���ܵ���( )
A.����
B.����ˮ����
C.��������
D.������Ȫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������н������·�Ӧ��X2(g)+Y2(g) ![]() 2Z(g)����֪X2��Y2��Z����ʼŨ�ȷֱ�Ϊ0.1 mol��L1��0.3 mol��L1��0.2 mol��L1����һ�������£�����Ӧ�ﵽƽ��ʱ�����ʵ�Ũ���п�����
2Z(g)����֪X2��Y2��Z����ʼŨ�ȷֱ�Ϊ0.1 mol��L1��0.3 mol��L1��0.2 mol��L1����һ�������£�����Ӧ�ﵽƽ��ʱ�����ʵ�Ũ���п�����
A��X2Ϊ0.2 mol��L1 B��Y2Ϊ0.45 mol��L1
C��ZΪ0.35 mol��L1 D��ZΪ0.4 mol��L1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ����Ҫ����Դ�������Ʊ�һϵ�����ʡ�����˵����ȷ����
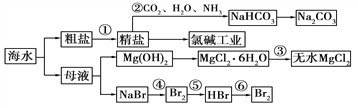
A. ������У�Ӧ��ͨCO2����ͨNH3
B. ��ȥ������SO42-��Ca2����Mg2�������ʣ������Լ�����ز���˳������ǣ�NaOH��Һ��BaCl2��Һ��Na2CO3��Һ������������
C. ������пɽ�MgCl2��6H2O����ֱ�ӽ��������Ƶ���ˮMgCl2
D. �������������Ӧ�У���Ԫ�ؾ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com