
【题目】下列反应中属于吸热反应的是( )
A.活泼金属与酸反应
B.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
C.酸碱中和反应
D.镁条燃烧
科目:高中化学 来源: 题型:
【题目】I.乙烯是一种重要的化工原料。根据下列转化关系回答:

(1)乙烯分子中官能团的名称是___________。
(2)![]() 的分子式是____________。
的分子式是____________。
(3)乙烯转化成A的化学方程式是_________________。反应类型是______。
II.乙烯在化工生产领域应用广泛。
以原油为起始原料合成聚乙烯的路线如下图所示。

(1)反应III的化学方程式:__________。反应类型是________。
(2)写出分子式符合C4H10的所有物质的结构简式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:锂离子电池的总反应为LixC+Li1-xCoO2![]() C+LiCoO2,锂硫电池的总反应为2Li+S
C+LiCoO2,锂硫电池的总反应为2Li+S![]() Li2S。有关两种电池说法正确的是 ( )
Li2S。有关两种电池说法正确的是 ( )
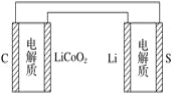
A. 锂离子电池放电时,Li+向负极迁移
B. 当锂硫电池充电时,硫电极发生氧化反应
C. 理论上两种电池的电极材料单位质量相同时释放的电能相同
D. 上图表示用锂离子电池给锂硫电池充电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如表所示:
元素编号 | 元素性质或原子结构 |
X | 其简单离子在第3周期元素的简单离子中半径最小 |
Y | 其最简单氢化物丙的水溶液呈碱性 |
Z | 原子核外电子数和周期序数相等 |
A、B、D三种单质(单质分别由X、Y、Z元素组成)和甲、乙、丙、丁、戊五种化合物之间的转化关系如图所示(某些条件已略去)。其中丁是一种火箭发动机的高能燃料,一个分子中含有18个电子,其组成元素与丙相同,戊是两性氢氧化物。
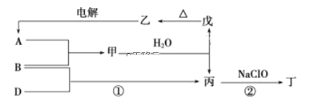
请回答:
(1)元素X在周期表中的位置是________,其简单离子的结构示意图为________。
(2)单质B电子式为________、丁电子式为________。
(3)丙中所包含的化学键类型有_______(填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,1 mol NaClO参加反应时,转移2 mol电子,其离子方程式为______________。
(5)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。该化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的的是
A. 乙烷(乙烯):通过酸性高锰酸钾溶液,洗气
B. 乙醇(水):加入新制生石灰,蒸馏
C. 溴苯(溴): 加入![]() 溶液,充分振荡静置后,分液
溶液,充分振荡静置后,分液
D. 乙酸(乙醇):加入金属钠,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列转化的化学方程式,注明反应类型。
(1)甲苯→TNT ___________________
(2)苯乙烯→聚苯乙烯__________________
(3)1,3—丁二烯与溴1,4—加成__________________
(4)2-甲基-2-溴丙烷和氢氧化钾乙醇溶液共热___________________
(5)苯甲醇在铜催化下和氧气反应__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用乙醇与浓硫酸的混合液加热的方法制取乙烯。反应中常因温度而发生副反应。请选用下列装置(装置可以使用多次)完成相关实验并回答有关问题:
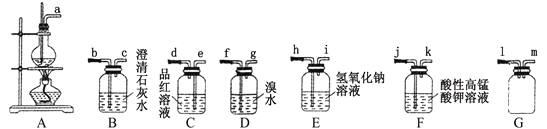
(1)制备乙烯时,常在A装置的烧瓶中加入碎瓷片,其目的是______________________;加热时要使溶液的温度迅速上升到140℃以上,因为在140℃左右易生成乙醚,该有机物的结构简式为_____________;生成乙烯的化学方程式为_____________________。
(2)乙醇与浓硫酸加热制取乙烯时,乙烯气体中常混有SO2和 CO2,为验证有副产物SO2和 CO2气体存在,上述仪器的连接顺序为a→_________________________________。
(3)某同学设计制备1,2-二溴乙烷的装置连接顺序为A→E→C→D。已知1,2-二溴乙烷的主要物理性质有:难溶于水、熔点9℃、沸点132℃、密度2.2 g·cm-3。
①E装置的作用_________________________;
②分离D装置中1,2-二溴乙烷的操作方法是加入试剂_______________ ,充分反应后进行______________操作。
③反应过程中,应将D装置放在10℃的水浴中,温度不宜过低、过高的原因是__________________________________________________。
(4)请设计验证酸性高锰酸钾溶液能将乙烯氧化为CO2的实验方案。装置连接顺序为A→_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:______与盐酸反应最剧烈,____与盐酸反应的速度最慢;____与盐酸反应产生的气体最多.
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为______________________________;
(3)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_________,________________;
Ⅱ.利用图装置可验证同主族元素非金属性的变化规律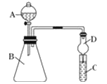
(4)干燥管D的作用为_______________;
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液________________________的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有______________溶液的洗气瓶.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是( )

A. 常温下,0.1 mol·L-1氨水中NH3·H2O的电离常数K约为1×10-5
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)=c(Cl-)
D. d点代表两溶液恰好完全反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com