
完成以下离子方程式或化学方程式:
(1)实验室制备氯气的离子方程式
(2)实验室制备氢氧化铝的离子方程式
(3)实验室制备氨气的化学方程式
(4)在实验室制备Fe(OH)2的过程中,常会出现白色沉淀迅速变成灰绿色,缓慢变成红褐色的现象。写出这步变化的化学方程式
(1)MnO2+4H++2Cl-  Mn2++Cl2↑+2H2O (2分)
Mn2++Cl2↑+2H2O (2分)
(2)Al3++3NH3·H20 = Al(OH)3↓+3NH4+ (2分)
(3)Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O (2分)
CaCl2+2NH3↑+2H2O (2分)
(4)4Fe(OH)2+O2+2H2O = 4Fe(OH)3
【解析】
试题分析:(1)实验室制备氯气用二氧化锰和浓盐酸在加热的条件下反应生成二氯化锰、氯气和水,离子方程式为:2Cl- + 4H+ + MnO2 Mn2+ + Cl2↑+ 2H2O,(2)实验室制备氢氧化铝,用可溶性铝盐和氨水反应,离子方程式为Al3+ + 3NH3·H2O=Al(OH)3↓+ 3NH4+,(3)实验室制备氨气用氯化铵和熟石灰共热,化学方程式为2NH4Cl + Ca(OH)2
Mn2+ + Cl2↑+ 2H2O,(2)实验室制备氢氧化铝,用可溶性铝盐和氨水反应,离子方程式为Al3+ + 3NH3·H2O=Al(OH)3↓+ 3NH4+,(3)实验室制备氨气用氯化铵和熟石灰共热,化学方程式为2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2H2O;(4)在实验室制备Fe(OH)2的过程中,常会出现白色沉淀迅速变成灰绿色,缓慢变成红褐色的现象,Fe(OH)2被氧化为氢氧化铁,化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
CaCl2 + 2NH3↑+ 2H2O;(4)在实验室制备Fe(OH)2的过程中,常会出现白色沉淀迅速变成灰绿色,缓慢变成红褐色的现象,Fe(OH)2被氧化为氢氧化铁,化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
考点:考查化学方程式的书写。


科目:高中化学 来源:2016届重庆市高一上学期期中考试化学试卷(解析版) 题型:选择题
能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶无色溶液加以区别的一种试剂是(必要时可加热)
A.BaCl2 B.NaOH C.Ba(OH)2 D.AgNO3
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高一上学期12月月考化学试卷(解析版) 题型:选择题
用下列方法来制备溶胶:①0.5 mol/L BaCl2溶液和等体积2mol/L硫酸相混合并振荡;
②把5、6滴饱和三氯化铁溶液滴加入20mL沸水中,边加边振荡;③将盐酸逐滴加入到饱和Na2SiO3溶液中,用力振荡。可行的是( )
A.①② B.①③ C.②③ D.①②③
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高一上学期12月月考化学试卷(解析版) 题型:选择题
下面叙述中,正确的是( )
A.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
B.水泥是重要的硅酸盐产品,以纯碱、石灰石、二氧化硅为原料
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅是一种亲氧元素,在自然界中它总是与氧相互化合
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省大连市高一上学期期末考试化学试卷(解析版) 题型:选择题
等量的铝,分别与足量的盐酸和氢氧化钠溶液充分反应,放出的氢气在同温同压下的体积比为
A.1:3 B.1:6 C.1:1 D.2:3
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省大连市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列关于Na2CO3和NaHCO3的性质比较中,不正确的是
A.热稳定性: Na2CO3 > NaHCO3
B.常温时在水中的溶解度:Na2CO3 > NaHCO3
C.与稀盐酸反应的剧烈程度:Na2CO3 > NaHCO3
D.等质量的固体与足量的盐酸反应放出CO2的质量:NaHCO3 > Na2CO3
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高一上学期期中考试化学试卷(解析版) 题型:填空题
实验室要配制1mol/L的稀硫酸250mL,回答下列问题:
(1)需要98%密度为1.84g/cm3的浓硫酸 mL
(2)配制时,必须使用的仪器有 (填代号) 还缺少的仪器是 。
①烧杯 ②100 mL量筒 ③20 mL量筒 ④1000 mL容量瓶 ⑤250 mL容量瓶 ⑥托盘天平(带砝码) ⑦玻璃棒
(3)配制时,该实验两次用到玻璃棒,其作用分别是 、 。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①没有洗涤烧杯和玻璃棒。 。
②如果加水超过了刻度线,取出水使液面恰好到刻度线。 。
③容量瓶没有干燥。
查看答案和解析>>
科目:高中化学 来源:2016届福建省宁德市高一上学期期末考试化学试卷(A)(解析版) 题型:实验题
某研究性学习小组的同学想通过下图实验装置探究SO2与Na2O2反应的产物。(夹持装置已略去,装置的气密性良好)
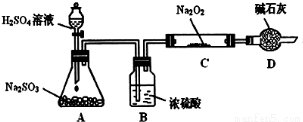
Ⅰ.实验中装置B可吸收水分,干燥SO2气体,其目的是:_________________________。
装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是:_________________。
Ⅱ.对C中固体产物提出如下假设:(假设Na2O2已全部反应)
假设1:__________。 假设2:只有Na2SO4; 假设3:既有Na2SO3又有Na2SO4。
(1)甲同学认为SO2与Na2O2的反应不同于CO2,应为假设2成立,请据此写出C中所发生反应的化学方程式:_____________________。
(2)若假设2成立,为确定C中固体产物的成分,甲同学设计如下实验:

得出结论:C中固体产物只有Na2SO4。该方案是否合理?答:__________。(填“是”或“否”)理由是______________________________。
(3)乙同学为证明假设3成立,设计如下实验。
实验步骤和结论为:
①取少量C中固体产物于试管中,加入适量的蒸馏水溶解;
②滴加过量的1mol?L-1BaCl2溶液,若产生白色沉淀,则证明C中固体产物中有_________;
③滴加适量的1mol?L-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,则证明C中固体产物中有___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com