
【题目】下列除去杂质的方法错误的是
物质 | 杂质 | 除杂剂 | |
A | 镁粉 | 铝粉 | 过量烧碱溶液 |
B | FeCl3(溶液) | FeCl2 | 氯气 |
C | CO2 | HCl | 饱和Na2CO3溶液 |
D | Cl2 | HCl | 饱和食盐水 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】已知有机物 A——G之间存在如下转化关系,除D以外其他物质均为芳香族化合物,其中化合物B分子中含有一个甲基,化合物D完全燃烧生成等物质的量的CO2 和H2O ,且D蒸汽与氢气的相对密度为30。回答下列问题:
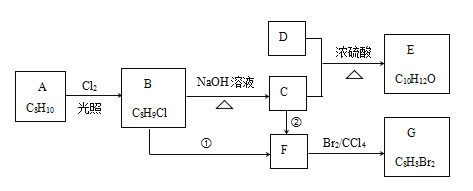
(1)化合物A的名称__________________,化合物D的分子式为_____________。
(2)① 的反应类型为 _____________。
② 需要的试剂和反应条件是______________________。
(3)C中含氧官能团的名称为___________。F的结构简式为___________。
(4)C + D![]() E的化学方程式为_____________________。
E的化学方程式为_____________________。
(5)同时符合下列条件的E的同分异构体有_____种,其中分子中有五种不同化学环境的氢,数目比为1:1:2:2:6 的结构简式为________________。
①苯环上有两个侧链 ②分子中含有两个甲基
③能发生水解反应且水解产物能使氯化铁溶液显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯: 6 H2(g) +2CO2(g)![]() CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
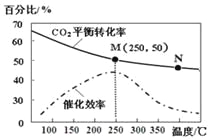
A. 生成乙烯的速率:v(M)一定小于v(N)
B. 化学平衡常数:KN>K M
C. 当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低
D. 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO。反应的热化学方程式如下:
I.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)H1=-53.7kJ/mol
CH3OH(g)+H2O(g)H1=-53.7kJ/mol
II.CO2(g)+H2(g)![]() CO(g)+ H2O(g)H2
CO(g)+ H2O(g)H2
某实验控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒,Cat.2:Cu/ZnO纳米片;
甲醇选择性:转化的CO2中生成甲醇的百分比。
已知: ①CO和H2的标准燃烧热分别为-283.0kJ/mol和285.8kJ/mol
②H2O(1)![]() H2O(g) H3=+440kJ/mol
H2O(g) H3=+440kJ/mol
请回答(不考虑温度对H的影响):
(1)a.反应II的H2=____kJ/mol。
b.800℃时,反应I和II对应的平衡常数分别为1.0和2.5,则该温度下反应:CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K的数值为_____。
CH3OH(g)的平衡常数K的数值为_____。
(2)在图中分别画出I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图(在图中标注出相应的催化剂) ____。
(3)工业生产甲醇还有如下方法:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
副反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
若生产过理中在恒压条件下通入水蒸气,从化学平衡的角度分析该操作对生产甲醇带来的利和弊____。
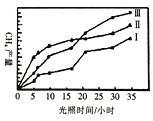
(4)利用光能和光催化剂,可將CO2和H2O(g)转化为CH4和O2。紫外线照射时,在不同催化剂(1、I、III)作用下,CH4产量随光照时间的变化如下图所示。下列说法正确的是____
A.催化剂能加快化学反应速率,在反应开始时对正反应的催化效果更好
B.从图中可知催化剂I的催化效果更好
C.若光照时间足够长,三条由线将相交于一点
D.光照15h前,无论用所给的哪种催化剂,该反应均未达到平衡
(5)人们正在研究某种锂一空气电池,它是一种环境友好的蓄电池。放电时的总反应为:4Li+O2=2Li2O。在充电时,阳极区发生的过程比较复杂,目前普遍认可是按两步反应进行,请补充完整。
电极反应式:______和Li2O2-2e-=2Li++O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)![]() pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
①体系的温度不再改变 ②体系的压强不再改变
③各组分的浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应
A. ③④⑤⑥B. ①③④⑥C. ②③④⑥D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂,用所学知识回答问题:
(1)3H2SO4+2KMnO4+5H2O2===K2SO4+2MnSO4+5O2↑+8H2O,当有6 mol H2SO4参加反应,有________mol还原剂被氧化。
(2)在稀硫酸中,KMnO4与H2C2O4反应的离子方程式为__________________________
(3)Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,再变为棕黄色,溶液先变为浅绿色的离子方程式是_______________ ,再变为棕黄色的原因是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据图回答下列问题:
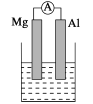
Ⅰ.(1)若烧杯中溶液为稀硫酸,则观察到的现象是__________,负极反应式为:_______________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应化学方程式为________________________________。
Ⅱ. (3)由Al、Cu、浓硝酸组成原电池,其负极的电极反应式为______________________。
Ⅲ.中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇(CH3OH)燃料电池的工作原理如下图所示。
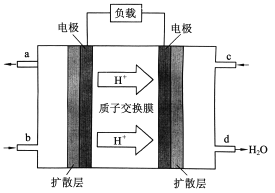
(4)该电池工作时,b口通入的物质为_______,c口通入的物质为______。
(5)该电池正极的电极反应式为:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com