

科目:高中化学 来源: 题型:阅读理解
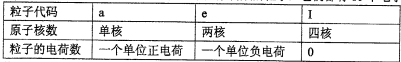


| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 氨气是一种重要的化工原料,但随着工业化进程的加快,氨气也逐渐变成居室里一种重要的污染性气体.
氨气是一种重要的化工原料,但随着工业化进程的加快,氨气也逐渐变成居室里一种重要的污染性气体.
| ||
| ||
| C2(NH3)?C(CO2) |
| C(H2O) |
| C2(NH3)?C(CO2) |
| C(H2O) |
查看答案和解析>>
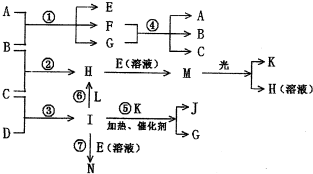
科目:高中化学 来源: 题型:
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。

请回答下列问题:
(1)X元素在周期表中的位置是第__________周期第___________族。
(2)下图是实验室模拟工业法合成C的简易装置。简述检验有C生成的方法_____________。

(3)在298 K时,Y(g)+3Z(g) ![]() 2C(g) ;ΔH=-92.4 kJ·mol-1,将Y、Z两种单质按物质的量比1∶3充入一密闭容器中。问:
2C(g) ;ΔH=-92.4 kJ·mol-1,将Y、Z两种单质按物质的量比1∶3充入一密闭容器中。问:
在298 K时,将10 mol Y和30 mol Z充入一密闭容器中,为何放出的热量小于924 kJ?_______________。
(4)C在一定条件下反应生成A的化学方程式是_______________。
(5)X、Y、Z三种元素可组成一种强酸D,C在适当条件下被D吸收生成一种盐E,25 ℃时,0.1 mol·L-1 E溶液中水的电离程度_______________(填“大于”“等于”或“小于”)0.1 mol·L-1 NaOH溶液中水的电离程度。若将0.1 mol·L-1 NaOH溶液和0.2 mol·L-1 E溶液等体积混合,所得溶液中离子浓度由大到小的顺序为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
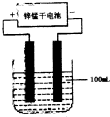
(Ⅰ)德国人哈伯在1905年发明的合成氨反应原理为:N2(g)+3H2(g) ![]() 2NH3(g);已知298 K时,ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1.试回答下列问题:
2NH3(g);已知298 K时,ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1.试回答下列问题:
(1)请根据正反应的焓变和熵变计算分析298 K下合成氨反应能自发进行(列出算式即可)___________________.其浓度熵(Qc) __________________化学平衡常数(Kc)(填“大于”“等于”或“小于”)时,反应向右进行.
(2)在实际工业合成氨生产中采取的措施是__________________ (填序号).
A.采用较低压强
B.采用800 K左右的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
(3)如下图所示是实验室模拟工业法合成氨的简易装置,简述检验有氨气生成的方法
___________________________________________________________________________
___________________________________________________________________________.

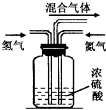
(Ⅱ)硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取.某校化学兴趣小组的同学设计了如下图所示装置利用中学实验室常见试剂制取NH3,并以空气,NH3为原料模拟工业制HNO3(三氧化二铬为催化剂,加热及夹持装置未画出):

回答下列问题:
(1)实验时,A,C两装置均需加热,应先加热______________装置,原因是___________________;
(2)D装置中应填充的物质是______________,该物质的主要作用是______________;
(3)E装置的作用是______________,F,G装置中的物质分别是______________、______________;
(4)若保留上图中黑色粗线框内的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在如下图所示的方框中画出装置图并注明所用药品的名称).

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com