
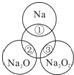
 如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| 1 |
| 2 |
| 1 |
| 2 |
| 4g |
| 100g+2.2g |
| 8g |
| 100g+6.2g |
| 8g |
| 100g+6.2g |


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
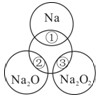 如图所示,两圆圈相交的部分表示圆圈内的物质之间能发生反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图所示,两圆圈相交的部分表示圆圈内的物质之间能发生反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| A、图中正中央圆圈代表的物质是氢氧化钠 | B、反应②的离子方程式为:O2-+H2O=2OH- | C、将反应①、③产生的气体收集混合并点燃可以产生图中正中央圆圈所代表的物质0.05mol,则③反应的还原产物为O2 | D、①、②充分反应后所得溶液的质量分数:②>① |
查看答案和解析>>
科目:高中化学 来源:2013届吉林省长春市实验中学高三上学期第一次月考化学试卷(带解析) 题型:单选题
如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应,其中属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )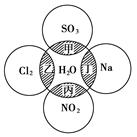
| A.甲、乙 | B.甲、丙 | C.乙、丙 | D.丙、丁 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省高三上学期期中考试化学试卷(解析版) 题型:选择题
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
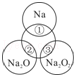
A.Na2O2中阴阳离子数目之比为1:1
B.反应①的离子方程式为:Na+2H2O=Na++2OH﹣+H2↑
C.反应③最多能产生0.05mol O2
D.①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省高三第一次阶段性考试化学试卷(解析版) 题型:选择题
如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g。下列说法正确的是

A.Na2O2中阴阳离子数目之比为1:1
B.反应①的离子方程式为:Na + 2H2O =Na+ + 2OH- + H2↑
C.反应③最多能产生0.05mol O2
D.①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com