
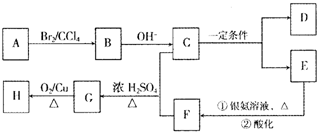
 (R、R′可以是烃基也可以是氢原子)
(R、R′可以是烃基也可以是氢原子)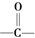 的异构体共有个
的异构体共有个| △ |
| 浓硫酸 |
| △ |
| △ |
| 浓硫酸 |
| △ |
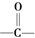 ,不包含F,则同分异构体含有酯基或醛基或羰基,符合条件同分异构体有:HCOOCH2CH3、CH3COOCH3、CH3CH(OH)CHO、HOCH2CH2CHO、CH3OCH2CHO、CH3COCH2OH,
,不包含F,则同分异构体含有酯基或醛基或羰基,符合条件同分异构体有:HCOOCH2CH3、CH3COOCH3、CH3CH(OH)CHO、HOCH2CH2CHO、CH3OCH2CHO、CH3COCH2OH,

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 10 |
| 加热温度/℃ | 25 | 70 | 80 | 100 | 130 | 250 | 300 | 350 | 400 | 450 |
| 固体质量/g | 42.2 | 42.2 | 40.1 | 36.8 | 36.8 | 36.8 | 36.8 | 36.8 | 32.0 | 32.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
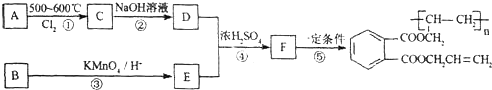
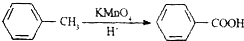
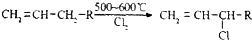
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应物分子必须碰撞才有可能发生反应 |
| B、发生有效碰撞的分子具有最高的能量 |
| C、有效碰撞是活化分子在一定方向上的碰撞 |
| D、活化分子的平均能量称之活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上以黄铁矿为原料,采用接触法生产硫酸.请回答下列问题:
工业上以黄铁矿为原料,采用接触法生产硫酸.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com