
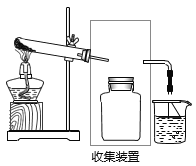
【题目】实验室用如图所示装置进行氨气实验。
(1)实验室常用 NH4Cl 与Ca(OH)2 制取氨气,该反应的化学方程式为______。
(2)若要收集一瓶氨气,请将下列甲装置补充完整,在虚框内画出连接图______。
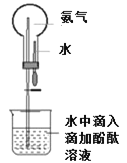
(3)用如图装置做喷泉实验。轻轻挤压滴管,使少量水进入烧瓶,打开止水夹,观察现象, 解释产生这一现象的原因______。
(4)如图为合成氨催化氧化制硝酸的流程示意图:
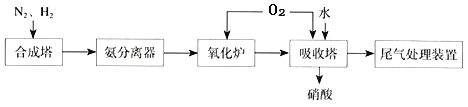
①合成塔中化学方程式为______。
②氧化炉中的化学方程式______。
③吸收塔 NO2![]() HNO3 氧化剂与还原剂物质的量之比为______。
HNO3 氧化剂与还原剂物质的量之比为______。
【答案】Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O ![]() NH3易溶于水,使烧瓶中的压强减小,烧杯中的水在大气压作用之下进入烧瓶,形成喷泉 N2+3H2
NH3易溶于水,使烧瓶中的压强减小,烧杯中的水在大气压作用之下进入烧瓶,形成喷泉 N2+3H2![]() 2NH3 4NH3+5O2
2NH3 4NH3+5O2![]() 4NO+6H2O 1:2
4NO+6H2O 1:2
【解析】
(1)氢氧化钙与氯化铵在加热条件下反应生成氨气、氯化钙和水;
(2)依据氨气极易溶于水,密度小于空气密度选择收集方法;
(3)NH3易溶于水,使烧瓶中的压强减小,烧杯中的水在大气压作用之下进入烧瓶,形成喷泉;
(4)①合成塔中氮气和氢气在高温、高压、催化剂作用下生成氨气;
②氧化炉中氨气和氧气在催化剂作用下生成一氧化氮和水;
③吸收塔 NO2和水反应生成一氧化氮和HNO3,根据氧化还原反应规律分析判断。
(1)氢氧化钙与氯化铵在加热条件下反应生成氨气、氯化钙和水,化学方程式:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)氨气极易溶于水,密度小于空气密度,所以应选择向下排空气法收集,可用装置:![]() 收集,进气时,应短进长处;
收集,进气时,应短进长处;
(3)轻轻挤压滴管,使少量水进入烧瓶,打开止水夹,因为NH3易溶于水,使烧瓶中的压强减小,烧杯中的水在大气压作用之下进入烧瓶,所以会形成喷泉;
(4)①合成塔中氮气和氢气在高温、高压、催化剂作用下生成氨气,方程式为:N2+3H2![]() 2NH3;
2NH3;
②氧化炉中氨气和氧气在催化剂作用下生成一氧化氮和水,方程式为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
③吸收塔 NO2和水反应生成一氧化氮和HNO3,方程式为:3NO2 + H2O = 2HNO3 +NO,反应中3molNO2参与反应,其中2mol NO2中的N元素化合价升高失电子,作还原剂,1mol NO2中的N元素化合价降低得电子,作氧化剂,氧化剂与还原剂物质的量之比为1:2。


科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20 ℃升温至30 ℃,溶液中c(CH3COO-)/c(CH3COOH)c(OH-)增大
C. 向盐酸中加入氨水至中性,溶液中![]() >1
>1
D. 常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(部分产物已略去)。下列说法正确的是( )
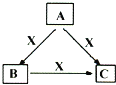
A. 若X为KOH溶液,则A可能为Al
B. 若X为Fe,则C可能为Fe(NO3)2溶液
C. 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D. 若X为O2,则A可为有机物乙醇,也可为非金属单质硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:
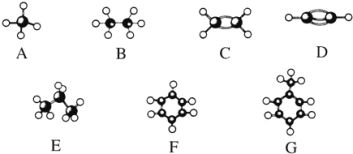
(1)E的一氯取代物同分异构有_______种。
(2)一卤代物种类最多的是________。(请填字母,下同)
(3)能够与Br2发生加成反应的两种气态烃是________。
(4)能够与酸性高锰酸钾反应的烃是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2气体缓缓地通入到含KOH、Ba(OH)2和K[Al(OH)4]的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述不正确的是
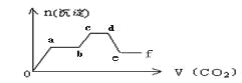
A. o—a段反应的化学方程式是:Ba(OH)2 + CO2 = BaCO3↓+ H2O
B. b—c段反应的离子方程式是:2[Al(OH)4]-+ CO2 = 2Al(OH)3↓ +CO32-+ H2O
C. a—b段与c—d段所发生的反应相同
D. d—e段沉淀的减少是由于碳酸钡固体的消失所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H等8种物质存在如下转化关系(反应条件,部分产物为标出).已知: A 是酸式盐,B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题:

(1)写出下列物质的化学式:A________,B________,写出B的一种危害__________。
(2)写出下列反应的化学方程式:E→F____________;红热的木炭与D的浓溶液反应的方程式:____________;铜与H的浓溶液反应的离子方程式:_____________。
(3)检验某溶液中是否含A 中阳离子的方法_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂联合生产等都是很好的“低碳”生产方式。下面是几家工厂利用废气、废液、废渣联合生产化肥硫酸铵的工艺:
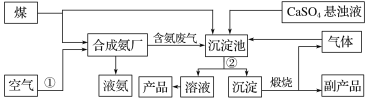
请回答下列问题:
(1)操作②为______________________________________________________。
(2)工业合成氨的化学方程式为_____________________。
(3)沉淀池中生成硫酸铵的化学方程式________________________________________。
(4)在实验室中检验氨气的方法是_________________________________。
(5)副产品的化学式为________。该联合生产工艺中可以循环使用的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
选项 | 试剂 | 实验目的 | 实验装置 | ||
X | Y | Z |
| ||
A | MnO2 | 浓盐酸 | KI-淀粉溶液 | 比较Cl2与I2的氧化性强弱 | |
B | 石灰石 | 浓盐酸 | Na2SiO3溶液 | C元素非金属性大于Si元素 | |
C | 蔗糖 | 浓硫酸 | 溴水 | 证明浓硫酸具有脱水性、氧化性 | |
D | Na2SO3 | 稀HNO3 | 品红溶液 | 证明SO2具有漂白性 | |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1molA(g)和1molB(g)充入2L密闭容器中发生反应:A(g)+B(g) ![]() xC(g)+D(s)△H<0,在 t1 时达平衡。在 t2 、t3 时刻分别改变反应的一个条件,测得容器中 C(g)的浓度随时间变化如图所示。下列有关说法正确的是
xC(g)+D(s)△H<0,在 t1 时达平衡。在 t2 、t3 时刻分别改变反应的一个条件,测得容器中 C(g)的浓度随时间变化如图所示。下列有关说法正确的是
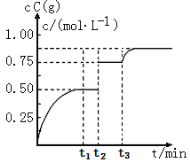
A. t2 时刻改变的条件是使用催化剂
B. t3时刻v(逆)可能小于t2 时刻v(逆)
C. t3时刻改变的条件一定是增大反应物的浓度
D. t1~t2、t2~t3平衡常数均为0.25
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com