
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4·2H2O工艺流程如下:
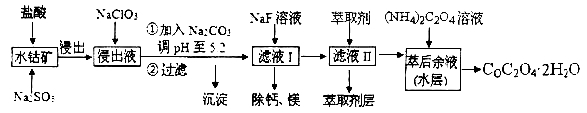
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

(1)浸出过程中加入Na2SO3的目的是_______________。
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为 ______________。
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀。试用离子方程式和必要的文字简述其原理:_____________________________________。
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液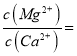 ______。
______。
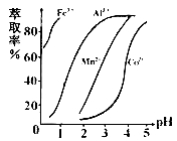
(5)萃取剂对金属离子的萃取率与pH的关系如右图所示,在滤液II中适宜萃取的pH为___左右。
a.1 b.2 c.3 d.4
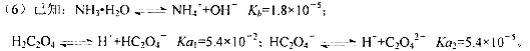
则该流程中所用(NH4)2C2O4溶液的pH_____7(填“>”或“<”或“=”)
(7)CoC2O4·2H2O热分解质量变化过程如右图所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是__________
【答案】
(1)还原Fe3+、Co3+为Fe2+、Co2+;
(2)ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O ;
(3)加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用M3+代替)的水解平衡M3++3H2O![]() M(OH)3+3H+,向右移动,而产生氢氧化物沉淀;
M(OH)3+3H+,向右移动,而产生氢氧化物沉淀;
(4)0.7,[Ksp(MgF2)÷Ksp(CaF2)= 7.35×10-11÷1.05×10-10=0.7;
(5)c;
(6)<;
(7)Co3O4;
【解析】
试题分析:浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;加入NaClO3可氧化亚铁离子,得到FeCl3,然后加入Na2CO3调pH至5.2,可得Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要有Co2+、Mn2+、Ca2+、Mg2+,加入NaF,除去Ca2+、Mg2+,再在滤液中加入萃取剂,最后得到CoC2O4;
(1)Na2SO3具有还原性,能将Co3+、Fe3+还原为Fe2+、Co2+;
(2)氯酸钠具有氧化性,能将浸出的亚铁离子氧化成铁离子,自身被还原为氯离子,同时生成水,离子方程式为:ClO2-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(3)加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+的水解平衡Fe3++3H2O![]() Fe(OH)3+3H+向右移动,从而产生氢氧化铁、氢氧化铝沉淀;
Fe(OH)3+3H+向右移动,从而产生氢氧化铁、氢氧化铝沉淀;
(4)当加入过量的氟化钠后,所得到滤液中镁离子与钙离子的比例等于氟化镁和氟化钙的溶度积的比值=7.35×10-11/1.05×10-10=0.7;
(5)由萃取剂对金属离子的萃取率与pH的关系图可知,溶液的pH是3.0时Mn2+完全萃取,答案选c;
(6)因NH3·H2O的Kb大于H2C2O4的Ka2,则(NH4)2C2O4溶液中NH4+比C2O42-的水解能力弱,溶液显酸性,即pH<7。
(7)由题意知,二水合草酸钴(CoC2O42H2O)的起始质量是18.3g,物质的量为0.1mol,其中Co元素的质量是5.9g,300℃时该固体分解为Co的氧化物,C点固体质量为8.03g,则O元素的质量是8.03g-5.9g=2.13g,物质的量是2.13g/16gmol-1=0.133125mol,则该固体中Co与O原子的物质的量之比是0.1: 0.133125=3:4,因此C点剩余固体的化学成分为Co3O4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备AlC13溶液,并用AlC13溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后锻烧沉淀制备新型的超导材料和发光材料七铝十二钙 (12CaO·7Al2O3)。已知A1C13易水解,易升华。
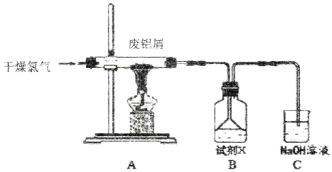
(1)①实验室用氯酸钾和浓盐酸制备氯气,其离子方程式为____________;
②C装置的作用____________;
(2)氯气与废铝屑反应生成的AlC13蒸气溶解在B中,B中盛放的试剂X是____________;为了防止AlC13蒸气凝华堵塞导管,实验中可采取的措施是____________(写出一点)。
(3)B装置中的AlC13溶液溶解CaCO3时,AlC13溶液和碳酸钙粉末的混合方式为____________;
(4)实验要控制碳酸钙和AlC13的量,要求n(CaCO3): n(A1C13)> 12:14,其原因是____________;
(5)以工业碳酸钙(含有少量A12O3、Fe2O3杂质)生产二水合氯化钙(CaC12·2H2O)的方法为:将工业碳酸钙溶于盐酸,____________。
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)

(实验中需用到的试剂和仪器有:盐酸,氢氧化钙,冰水,pH计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素。由此推断:
(1)甲元素在周期表中位置是________;
(2)甲的单质与水反应的离子方程式为____;乙单质与丙单质反应的化学方程式为_________。
(3)甲元素和丙元素的最高价氧化物对应水合物的碱性较强的是_______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷分子中的四个氢原子都可以被取代。若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如下所示,对所得分子的描述,正确的是
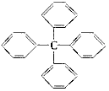
A.此物质分子式为C25H18,属于苯的同系物
B.其一氯代物共有四种
C.此分子最多有13个碳原子在一个平面上
D.该物质能使溴水因化学反应而褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是 、 。
(2)取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是 。
(3)在40.0 mL 0.065 mol·L-1 Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过 mL。
(4)将不纯的NaOH样品1 g(样品含少量Na2CO3和水),放入50 mL 2 mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到 克固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从有机反应![]() 制取副产品盐酸的设想己成为现实。请根据所给模拟装置图回答下列问题:
制取副产品盐酸的设想己成为现实。请根据所给模拟装置图回答下列问题:
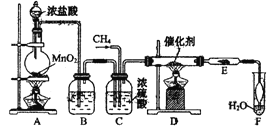
(1)写出实验室制Cl2的离子方程式________________________。
(2)装置B中盛放的溶液是____________;作用是___________________。
(3)装置C有三种功能:①_________;②__________;③观察气泡的产生情况,便于控制两种气体的配比。
(4)玻璃管E中放在石棉碎块上的碘化钾的作用是:_______________。导管末端“肚形”装置的作用是____________________________。
(5)从F中分离出盐酸的最佳方法是____________。该套实验装置还存在的缺陷是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(HF)2(g) ![]() 2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
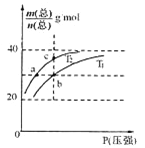
A.温度:T1< T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:v(b)>v(a)
D.当![]() 30g·mol-1时,n(HF):n[(HF)2]=2:1
30g·mol-1时,n(HF):n[(HF)2]=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月5日,我国女药学家屠哟哟发现青蒿素(分子式为C15H22O5)治疗疟疾。而荣获2015年诺贝尔生理学医学奖。青蒿素的一种化学合成路线部分工艺流程(→……→表示省略了许多步骤)如下:
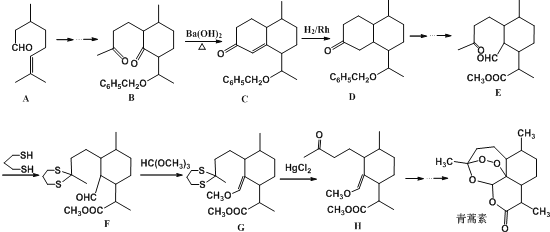
(1)1mol青蒿素完全燃烧消耗O2的物质的量为___________。
(2) A中含氧官能团的名称___________,该物质核磁共振氢谱中一共有___________个吸收峰,C→D的反应类型___________,B→C实际上是分两步反应进行的,先进行加成反应,再进行___________反应。
(3)写出丙酮![]() 与
与![]() 一定条件下反应的化学方程式___________;合成路线中设计由E→F与G→H的目的是___________;
一定条件下反应的化学方程式___________;合成路线中设计由E→F与G→H的目的是___________;
(4)任写一种同时满足以下条件的青蒿素的同分异构体的结构简式___________;
①能与FeC13溶液发生显色反应
②能与NaHCO3溶液反应
③lmol该物质与足量NaOH反应消耗4mo1NaOH
④该物质核磁共振氢谱中有6组吸收峰.且峰面积之比为1:1:2:2:4:12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)有机化合物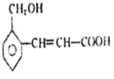 可能发生的化学反应有
可能发生的化学反应有
①加成 ②氧化 ③燃烧 ④加聚 ⑤取代
A.①②③ B.①②③④⑤ C.①②③④ D.①③④
(二)已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成食品包装材料。
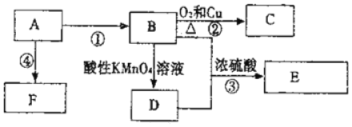
(1)A的结构简式为 。
(2)D分子中的官能团是 。
(3)写出下列反应的化学方程式。
② 。
④ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com