
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
| A. | K、L、M三种元素的金属性逐渐增加 | |
| B. | 在RCl2分子中,各原子均满足8电子的稳定结构 | |
| C. | Q元素的最高价氧化物为电解质,其水溶液能够导电 | |
| D. | K在T单质中燃烧所形成的化合物中阳离子与阴离子数目之比为2:1 |
分析 短周期元素,Q、T均有-2价,处于ⅥA族,Q有+6价气味原子半径Q>T,故Q为S元素、T为O元素;L、R均有+2价,处于ⅡA族,原子半径L>R,故L为Mg、R为Be;M有+3价,原子半径大于硫,故M为Al;K、N均有+1价,处于IA族,原子半径K>N>Al,故K为Na、N为Li,据此解答.
解答 解:短周期元素,Q、T均有-2价,处于ⅥA族,Q有+6价气味原子半径Q>T,故Q为S元素、T为O元素;L、R均有+2价,处于ⅡA族,原子半径L>R,故L为Mg、R为Be;M有+3价,原子半径大于硫,故M为Al;K、N均有+1价,处于IA族,原子半径K>N>Al,故K为Na、N为Li.
A.同周期自左而右金属性减弱,故金属性M(Al)<L(Mg)<K(Na),故A错误;
B.在BeCl2分子中,Be原子不满足8电子的稳定结构,故B错误;
C.Q元素的最高价氧化物为SO3,属于非电解质,故C错误;
D.K在T单质中燃烧所形成的化合物为Na2O2,由钠离子与过氧根离子构成,阳离子与阴离子数目之比为2:1,故D正确,
故选:D.
点评 本题考查结构性质位置关系应用,关键是根据化合价与原子半径推断元素,注意对元素周期律的理解掌握.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题

| A. | 反应物的总键能高于生成物的总键能 | |
| B. | 曲线a是使用了催化剂的能量变化曲线 | |
| C. | 热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H=-91kJ•mol-1 | |
| D. | CO(g)+2H2(g)?CH3OH(1)(g)△H>-91kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g苯中含有碳碳双键数目为3NA | |
| B. | 5g质量分数为46%的乙醇溶液中,氢原子的总数为0.6NA | |
| C. | 常温常压下,46gNO2与N2O4的混合气体中含有的原子总数为3NA | |
| D. | 50mL12mol•L-1浓盐酸与足量二氧化锰加热反应,转移电子数小于0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,含有的化学键为极性键、非极性键(填“极性键”、“非极性键”、“离子键”).
,含有的化学键为极性键、非极性键(填“极性键”、“非极性键”、“离子键”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30mL 30mol•L-1 | B. | 25mL 2mol•L-1 | C. | 10mL 1mol•L-1 | D. | 18mL 4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用12.6gCH2═CHCl和12.5g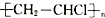 中含有氯原子数均为0.2NA 中含有氯原子数均为0.2NA | |
| B. | 18g2H2O和18g3H2O中含有质子数均为10NA | |
| C. | 23gNa与氧气完全反应,消耗氧气分子数一定为0.5NA | |
| D. | 84gNaHCO3固体和106gNa2CO3固体中CO32-的数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com