
【题目】下列反应属于氧化还原反应的是 ( )
A. H2SO4+2NaOH=Na2SO4+2H2O B. CuO+H2![]() Cu+ H2O
Cu+ H2O
C. NH3+HCl=NH4Cl D. 2NaHCO3![]() Na2CO3+ H2O +CO2↑
Na2CO3+ H2O +CO2↑
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
①2Fe2O3(s)+3C(s)4Fe(s)+3CO2(g)△H=+460.5KJmol﹣1
②Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)△H=﹣28.5KJmol﹣1
③断裂1mol CO(s)气体中的化学键需要吸收1076KJ的能量
断裂1mol CO2(s)气体中的化学键需要吸收1490KJ的能量
请回答:
(1)断裂1mol C(s)中所有化学键需要吸收的能量为 .
(2)T1℃时,向密闭容器中加入一定量的Fe2O3和C,发生反应①,达到平衡后,CO2的浓度为a molL﹣1;其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b molL﹣1 , 则a(选填“>”“<”或“=”)b.
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的Fe2O3和CO发生反应②,测得相关数据如表所示:
编号 | 容器 | 起始时物质的量 mol | 平衡时物质的量/mol | 平衡常数(K) | |
Fe2O3 | CO | Fe | |||
1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
2 | 恒温 | 2 | 3 | m | K2 |
3 | 绝热 | 1 | 1.5 | n | K3 |
①T2℃时,容器1中反应的平衡常数K1= .
②容器2中,5min达到平衡,则0~5min内以CO2表示该反应的速率v(CO2)= .
③对于三个容器中的反应,下列说法正确的是(填选项字母).
A.m>2n
B.容器1和容器2中CO的平衡转化率v1<v2 .
C.K1=K3
D.平衡时气体压强:P3>P1
(4)T2℃时,向恒压密闭容器中充入0.5mol Fe2O3和1.0mol CO,发生反应②,CO和CO2的物质的量浓度(c)与时间(t)的关系如图1所示. 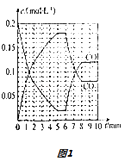
①6min时,改变的外界条件未 , 理由为 .
②10min时,再向容器中加入1 mol Fe2O3、1 mol CO、1 mol Fe、1 mol CO2、起始的反应速率v(正)(选填“>”“<”或“=”)v(逆).
(5)CO﹣O2熔融盐燃料电池的装置如图2所示,电池工作时,C口产生的气体一部分通入B口被利用,另一部分被分离出来,若导线中流过2mole﹣ , 理论上C口被分离出的气体的物质的量最多为 . 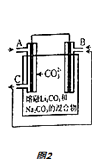
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,则下列叙述中正确的是 ( )
A. 6.02×1022个H2SO4分子在水中可电离生成2NA个H+
B. 在0℃、101 kPa时,22.4 L氢气中含有NA个氢原子
C. 14 g氮气中含有7NA个电子
D. NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法能够说明氮的非金属性比磷强的是
A.HNO3比H3PO4更稳定B.HNO3的氧化性比H3PO4强
C.HNO3的酸性比H3PO4强D.HNO3比H3PO4容易挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图链接,C、D、E、F、X、Y都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附件先显红色.试回答下列问题: 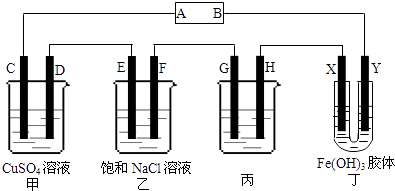
(1)电源A极的名称是
(2)甲装置中电解反应的总化学方程式:
(3)如果收集乙装置中产生的气体,相同状况下两种气体的体积比是 .
(4)欲用丙装置给铜镀银,G应该是(填“铜”或“银”),电镀液的溶质是(填化学式).
(5)装置丁中的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁的有关知识,回答下列各题。
(1)据有关报道。目前已能冶炼出纯度高达99.999%的铁,下列关于纯铁的叙述中,正确的是____________。
A.耐腐蚀性强,不易生锈 B.不能与盐酸反应
C.与不锈钢成分相同 D.在地壳中含量仅次于铝
(2)向沸水中逐滴滴加1mol·L-1FeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒直径的范围是______________,写出反应的离子方程式:___________________。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式:________________________________。
检验反应后的溶液中存在Fe3+的试剂是__________________________________。
(4)欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液。下列试剂中,需要用到的一组是______(填字母)。
①蒸馏水 ②铁粉 ③浓硝酸 ④浓盐酸 ④烧碱 ⑤浓氨水 ⑥氯水
A.①②④⑥ B.①③④⑥ C.②④⑤ D.①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质(括号的物质为杂质)的方法中,错误的是( )
A.FeCl3溶液(FeCl2):通入适量Cl2
B.CO(CO2):通过NaOH溶液洗气后干燥
C.MnO2(KCl):加水溶解后过滤、洗涤、烘干
D.SO2(HCl):通过饱和Na2CO3溶液洗气后干燥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com