
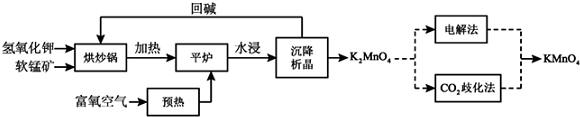
分析 软锰矿氢氧化钾按的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,提高反应速率,加热通入预热的空气,在“平炉”中发生反应2MnO2+4KOH+O2$\frac{\underline{\;\;△\;\;}}{\;}$2K2MnO4+2H2O,生成物质水浸沉降析出晶体得到锰酸钾,CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和KHCO3,“电解法”为现代工艺,即电解K2MnO4水溶液,在电解槽中阳极,MnO42-失去电子,发生氧化反应,产生MnO4-.
(1)固体混合粉碎目的是增大接触面积加快反应速率;
(2)流程分析可知平炉中发生的反应是氢氧化钾、二氧化锰和氧气加热反应生成锰酸钾和水;
(3)“平炉”中加压能提高氧气的压强,加快反应速率,增加软锰矿转化率;
(4)①在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,根据元素守恒以及二氧化碳过量推测反应生成KMnO4,MnO2和KHCO3;
②“电解法”为现代工艺,即电解K2MnO4水溶液,在电解槽中阳极,MnO42-失去电子,发生氧化反应,产生MnO4-;在阴极,水电离产生的H+获得电子变为氢气逸出,电极反应式是:2H2O+2e-=H2↑+2OH-;
③依据电解法方程式2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+2H2↑+2KOH,可知K2MnO4的理论利用率是100%,而在二氧化碳歧化法反应中3K2MnO4+2CO2=2KMnO4+MnO2+K2CO3中K2MnO4的理论利用率是$\frac{2}{3}$;
(5)依据离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可由n(H2C2O4)计算出n(KMnO4),进而计算出样品中的n(KMnO4),然后可计算样品的纯度.
解答 解:(1)原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是增大接触面积加快反应速率,提高原料利用率.
故答案为:增大反应物接触面积,加快反应速率,提高原料利用率;
(2)流程分析可知平炉中发生的反应是氢氧化钾、二氧化锰和氧气加热反应生成锰酸钾和水,反应的化学方程式为:2MnO2+4KOH+O2=2K2MnO4+2H2O,
故答案为:2MnO2+4KOH+O2$\frac{\underline{\;\;△\;\;}}{\;}$2K2MnO4+2H2O;
(3)“平炉”中加压能提高氧气的压强,加快反应速率,增加软锰矿转化率.
故答案为:提高氧气的压强,加快反应速率,增加软锰矿转化率;
(4)①在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,根据元素守恒以及二氧化碳过量推测反应生成KMnO4,MnO2和KHCO3;
故答案为:KHCO3;
②“电解法”为现代工艺,即电解K2MnO4水溶液,在电解槽中阳极,MnO42-失去电子,发生氧化反应,产生MnO4-.电极反应式是:MnO42--e-=MnO4-;在阴极,水电离产生的H+获得电子变为氢气逸出,电极反应式是:2H2O+2e-=H2↑+2OH-;所以阴极逸出的气体是H2;总反应方程式是:2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+2H2↑+2KOH,
故答案为:MnO42--e-=MnO4-;H2;
③依据电解法方程式2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+2H2↑+2KOH,可知K2MnO4的理论利用率是100%,而在二氧化碳歧化法反应中3K2MnO4+2CO2=2KMnO4+MnO2+K2CO3中K2MnO4的理论利用率是$\frac{2}{3}$,所以二者的理论利用率之比为3:2,
故答案为:3:2;
(5)发生2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
可知KMnO4与草酸反应的定量关系是2KMnO4~5H2C2O4,
n(H2C2O4)=20.00×10-3L×0.2000mol/L=20.00×10-3×0.2000mol
n(KMnO4)=20.00×10-3×0.2000×$\frac{2}{3}$mol,
1.0800g样品中n(KMnO4)=20.00×10-3×0.2000×$\frac{2}{5}$×$\frac{100}{24.48}$mol,
1.0800g样品中m(KMnO4)=20.00×10-3×0.2000×$\frac{2}{5}$×$\frac{100}{24.48}$×158g,
样品的纯度=$\frac{\frac{2}{5}×0.2000×20.00×1{0}^{-3}×\frac{100}{24.48}×158}{1.0800}$×100%=95.6%.
故答案为:95.6%.
点评 本题考查了物质制备工艺流程的知识.制备方案的过程分析和物质性质的理解应用,特别是电解原理、滴定实验的熟练掌握和计算应用,掌握基础是解题关键,题目难度中等.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
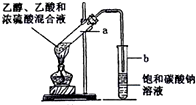 如图为实验室制取乙酸乙酯的装置.
如图为实验室制取乙酸乙酯的装置.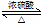 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
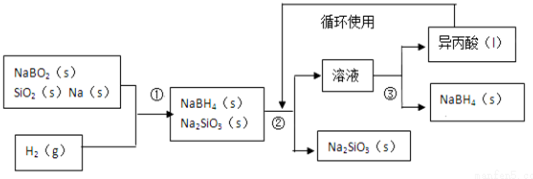
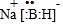 ;其中B元素的化合价为+3
;其中B元素的化合价为+3查看答案和解析>>
科目:高中化学 来源: 题型:解答题
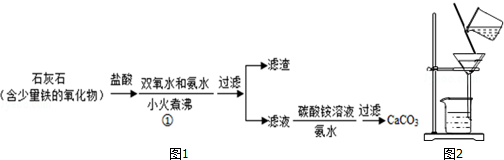
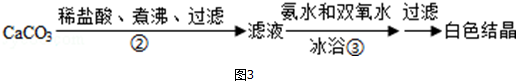
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
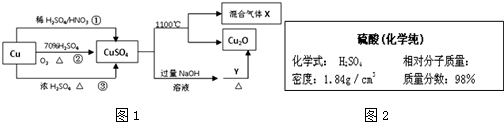
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖(C12H22O11) | 25.00 | 342 |
| 硫酸钾 | 0.84 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com