
【题目】有关氧化还原反应实质的说法中正确的是 ( )
A.是否有原子的重新组合 B.是否有元素的化合价的变化
C.是否有氧元素的参加 D.是否有元素原子的电子转移
科目:高中化学 来源: 题型:
【题目】(2016课标Ⅰ)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的_________,反应的化学方程式为_______________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子能在溶液中大量共存的是( )
A.H+Ca2+ Cl﹣CO32﹣
B.Na+ Mg2+SO42﹣ OH﹣
C.K+ Na+ OH﹣ Cl﹣
D.Cu2+ Ba2+ Cl﹣ SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A.溶液中OH-向电极a移动
B.O2在电极b上发生还原反应
C.反应消耗的NH3与O2的物质的量之比为 4:5
D.电极 a 的反应式为 2NH3-6e-+6OH-=N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N![]() N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是
N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是

A. N4属于一种新型的化合物
B. N4分子中存在非极性键
C. N4分子中N—N键角为109°28′
D. 1 mol N4转变成N2将吸收882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组对Na2SO3和AgNO3在不同pH下的反应及产物,进行了以下实验探究。
查阅资料:
Ⅰ.Ag2SO3:白色、难溶于水;
Ⅱ.Ag2O:棕黑色、难溶于水,易与酸溶液反应。
(1)根据资料:①通常情况Na2SO3溶液和AgNO3溶液反应产生的现象是________。
②若Ag2O与盐酸反应,其化学方程式应为___________。
(2)检测溶液pH:①0.1mol/LAgNO3溶液的pH=5,引发这一结果的微粒是________。
②0.1mol/LNa2SO3溶液的pH=10,其原因用离子方程式解释是________。
(3)实验探究:在不同pH条件下Na2SO3溶液与AgNO3溶液混合反应。
实验记录如下:

Ⅰ.实验a中沉淀溶解消失的原因,可能是___________。
Ⅱ.Ag2SO3在溶液中沉淀析出的大致pH范围是_________。
Ⅲ.将d中棕黑色絮状物X滤出、洗净、进行实验分析:
实验 | 操作 | 现象 |
ⅰ | 将其置于试管中加稀盐酸、观察 | 无明显现象 |
ⅱ | 将其置于试管中加足量浓硝酸、观察 | 立即产生红棕色气体 |
ⅲ | 在ⅱ反应所得溶液中,加Ba(NO3) 2溶液、观察,再加BaCl2、观察 | 前者无明显现象,后者出现白色沉淀 |
①由实验ⅰ得出的结论是_________。
②d中的棕黑色絮状物X是_________。
③实验ⅱ中的化学反应方程式是___________。
(4)小组认为在酸性条件下,SO32-的________性增强,生成X的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备乙酸乙酯的装置,如图所示,回答下列问题:
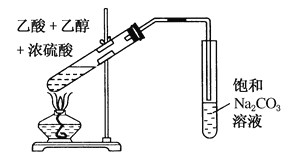
(1)乙醇、乙酸和浓硫酸混合时,应为_______________________________________。
(2)收集乙酸乙酯的试管内盛有的饱和碳酸钠溶液的作用是_________________________。
(3)反应中浓硫酸的作用是________________________________。
(4)反应中乙醇和乙酸的转化率不能达到100%,原因是__________________________。
(5)将收集到的乙酸乙酯分离出来的方法为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)( )
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2 +2OH-=== Cl-+ ClO-+ H2O
B.该消毒液的pH约为12:ClO-+ H2O![]() HClO+ OH-
HClO+ OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2 ↑+ H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+ CH3COO—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com