
 二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料,已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol.工业上制备二甲醚的主要方法经历了三个阶段:
二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料,已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol.工业上制备二甲醚的主要方法经历了三个阶段:
分析 (1)根据盖斯定律已知①CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol;
②3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247kJ/mol,反应CO(g)+H2(g)+O2(g)=CO2(g)+H2O(1)可以是$\frac{1}{3}$(①+②)得到,来计算并书写即可;
(2)A.低温高压均能使得化学平衡正向移动,可以提高CO的转化率;
B.加催化剂,不会改变转化率;
C.增加CO浓度,会使其转化率减小;
D.分离出二甲醚,能使得化学平衡正向移动,可以提高CO的转化率;
(3)对于反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0,压强越大,甲醇的物质的量分数则越大,温度越高,甲醇的物质的量分数越小,由此分析解题;
(4)根据燃料电池的工作原理以及电极反应式的书写方法来回答判断.
解答 解:(1)已知①CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol;
②3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247kJ/mol,
反应CO(g)+H2(g)+O2(g)=CO2(g)+H2O(1)可以是$\frac{1}{3}$(①+②)得到,所以△H=-567.3kJ/mol,
故答案为:CO(g)+H2(g)+O2(g)=CO2(g)+H2O(1)△H=-567.3kJ/mol;
(2)A.低温高压均能使得化学平衡正向移动,可以提高CO的转化率,故A正确;
B.加催化剂,不会改变转化率,故B错误;
C.增加CO浓度,会使其转化率减小,故C错误;
D.分离出二甲醚,能使得化学平衡正向移动,可以提高CO的转化率,故D正确;
故选AD;
(3)对于反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0,压强越大,甲醇的物质的量分数则越大,温度越高,甲醇的物质的量分数越小,所以P1>P3、T1>T3,P1>P4、T2>T3,故答案为:CD;
(4)燃料电池中,通入燃料二甲醚的电极X是负极,该极上发生失电子的氧化反应,即CH3OCH3-12e-+3H2O=2CO2+12H+,
故答案为:CH3OCH3-12e-+3H2O=2CO2+12H+.
点评 本题考查了运用盖斯定律计算焓变、热化学方程式的书写、影响化学平衡的因素、燃料电池等重要考点,涉及的知识点较多,综合性较强,难度较大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 锌片发生氧化反应 | B. | 电子由锌片通过导线流向铜片 | ||
| C. | 铜片反应式为Cu2++2e-═Cu | D. | 该电池的反应本质是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成离子键的阴、阳离子间只存在静电吸引力 | |
| B. | 核外电子排布相同的微粒,化学性质相同 | |
| C. | 所有物质中均存在化学键 | |
| D. | 离子化合物中一定含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的工作环境是高温条件 | |
| B. | 作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原 | |
| C. | 该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等 | |
| D. | 该电池的总反应为C6H12O6+6O2$\frac{\underline{\;催化剂\;}}{\;}$6CO2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在酸性溶液中:Ba2+、Na+、SO42-、Cl- | |
| C. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 含大量Fe2+溶液中:K+、Cl-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
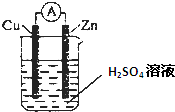 某学习小组针对化学能转变为其他形式的能量,进行如下实验:
某学习小组针对化学能转变为其他形式的能量,进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

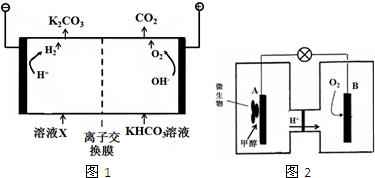
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com