
����Ŀ����0.1 mol��þ�������������100 mL2 mol/L��H2SO4��Һ�У�Ȼ���ٵμ�1 mol/LNaOH��Һ����ش�
��1�����ڵμ�NaOH��Һ�Ĺ����У���������m �����NaOH��Һ�����V�仯��ͼ��ʾ����V1=160 mL ʱ���������ĩ��n(Mg) = __________mol ��V2��_________mL ��

��2�����ڵμ�NaOH��Һ�����У���ʹMg2+��Al3+�պó�����ȫ�������NaOH��Һ�����V (NaOH) = __________mL ��
��3�����������Ϊ0.1mol������Mg�۵����ʵ�������Ϊa����100 mL 2 mol/L�������ܽ�˻������ټ���450 mL 1 mol/L��NaOH��Һ�����ó�������Al(OH)3�������������a��ȡֵ��Χ�ǣ�____________��
���𰸡���1��0.06mol��440mL ��2��400mL ��3��0.5��a<1��
��������
�����������1��100mL 2molL-1��H2SO4��Һ����������ʵ���Ϊ0.1L��2mol/L=0.2mol��
��V1=160mLʱ����ʱ����Һ��MgSO4��Al2(SO4)3��Na2SO4���Һ��
��Na+�����غ��֪��n(Na2SO4)=1/2n(Na+)=1/2n(NaOH)=1/2��0.16L��1mol/L=0.08mol
��MgSO4Ϊxmol��Al2(SO4)3Ϊymol����
����Mgԭ�ӡ�Alԭ���غ��У�x+2y=0.1
����SO42-�����غ��У�x+3y=0.2-0.08
�������̣���ã�x=0.06��y=0.02
���Խ�����ĩ��n(Mg)=0.06mol��n(Al)=2y=2��0.02mol=0.04mol
�μ�NaOH��Һ�����V2ʱ����Һ��Na2SO4��NaAlO2���Һ������SO42-���ӡ�Na+���Ӻ�Alԭ���غ��У�
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2��0.2mol��+0.04mol=0.44mol�����ԣ�V2=0.44mol��1mol/L=0.44L=440mL��
��2������Һ��Mg2+��Al3+ǡ�ó�����ȫʱ����ʱ��Һ��Na2SO4��Һ������SO42-���Ӻ�Na+�����غ��У�n(Na+)=2n(Na2SO4)=2(H2SO4)=2��0.1L��2mol/L=0.4mol������V(NaOH)=0.4mol��1mol/L=0.4L=400ml��
��3������Ϊ����������a��1��Al�����ʵ���Ϊ0.1(1-a)mol����Ӧ��Ļ����Һ���ټ���450mL 1mol/L��NaOH��Һ�����ó�������Al(OH)3������Ϊ�����ơ�ƫ�����ƣ�������Ԫ���غ��֪n(NaAlO2)=0.1(1-a)mol�������������غ㣬Ӧ����n(NaOH)��2n(Na2SO4)+n(NaAlO2)����0.45��1��2��0.1��2+0.1(1-a)�����a��0.5����0.5��a��1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������У������ᷴӦ����������ˮ����(����)
A. ������ B. ���� C. �� D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mLijδ֪Ũ�ȵ�AlCl3��Һ�ֱ�ӵ�60mL1molL��1��NaOH��Һ��60mL3molL��1��NaOH��Һ�У����ܵõ�1��56gAl(OH)3���������AlCl3��Һ��Ũ�ȿ�����( )
A��1molL��1 B��0��5molL��1 C��0��6molL��1 D��0��4molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ��Һ���ܴ��������һ�������ǣ� ��
A.NH4+��Ba2+��OH����CO32��
B.Cl����SO32����Fe2+��H+
C.K+��Mg2+��SO42����Cl��
D.Na+��H+��NO3����HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���⡣��������֪��Br2�ķе�Ϊ58.8�����ܶ�Ϊ3.119g��cm-3����ˮ���ж���
������1�������£�������ͨ���� ̬������ʱͨ����ʢ����Լ�ƿ�м������� ��
������ҵ�����У���ˮ��ȡ�峣�ÿ��������������������̿�����ͼ��ʾ��
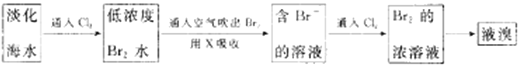
ij��ѧʵ��С��ģ��÷����������ʵ��װ�ã��г�װ����ȥ����Ũ���ĺ�ˮ����ȡҺ��
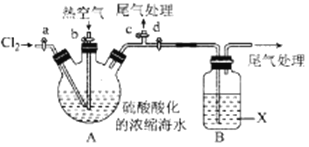
ʵ�鲽�����£�
�� �رջ���b��d������a��c����A�л���ͨ��Cl2����Ӧ������
�� �ر�a��c����b��d����A�й��������ȿ�����
�� �ر�b����a����ͨ��A��B��ͨ��������Cl2��
�� ��B������Һ����������ռ�Һ�塣
��2�����۲쵽A��Һ���Ϸ����� ��ʵ���������жϲ������з�Ӧ�Ѿ�������
��3��X�Լ������� ������ţ���β������ѡ�� ������ţ���
a��H2O b������ʳ��ˮ c������������Һ D������Na2SO3��Һ
B��X�Լ�������Ӧ�����ӷ���ʽΪ ��
��4������ʱӦ��ѡ�� ��������Ӧ���ƵĹؼ�ʵ������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.01 molNaOH��0.01 molNa2CO3��ϲ������Һ������Һ�еμ�0.1mol/Lϡ���ᡣ����ͼ������ȷ��ʾ������������������CO2�����ʵ����Ĺ�ϵ����( )
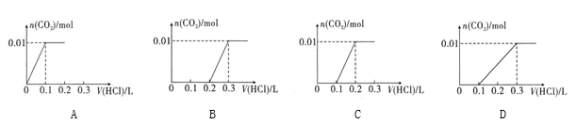
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������س��õ�NaNO2����ۺ�ʳ�����ƣ�������ζ������ʹ����ʳ�ж�����֪NaNO2�ܷ�����Ӧ����Ӧ���������У�NaNO2��NO��I2��NaI��H2O��HI��
��1��д����ѧ��Ӧ����ʽ����˫���ű������ת�������________��
��2����ԭ������_________������Ӧ��ת�Ƶ�������Ϊ4NAʱ������������Ӧ�����ʵ����ʵ�����_______��
��3������������Ӧ��������ֽ�������г��������ʽ���ʵ�飬�Լ���NaNO2��NaCl����ѡ�õ������У�
��ˮ�����⻯�ص�����ֽ�������ۣ����ƣ���ʳ�ס�����ѡ����ʵ���( )
A���ۢ� B���٢ڢ� C���٢ڢ� D���٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AΪ���ϩ�����߷��Ӳ���PET������֬��PMMA�ĺϳ�·�����£�

�����Ϣ���£�

��ش��������⣺
��1������˵����ȷ���� ��������ĸ��ţ�
A��������F�ܷ���������Ӧ
B��������E�뻯����D��Ϊͬϵ��
C��������G�ܷ������۷�Ӧ���ɾ���
D��1 mol PMMA������NaOH��Һ��Ӧ�������1 mol NaOH
��2����֪![]() ��ͬ���칹���ж��֣�д��ͬʱ��������������ͬ���칹�� ��
��ͬ���칹���ж��֣�д��ͬʱ��������������ͬ���칹�� ��
���������ʵ���֮��1:2��NaHCO3��Һ������Ӧ��
��������ױ��������к���һ������CH3����
��1H-NMR����ʾ�����к��б������ұ����������ֲ�ͬ��ѧ��������ԭ�ӡ�
��3��PET����Ľṹ��ʽΪ ��
��4��D+I��PMMA����Ļ�ѧ����ʽΪ ��
��5�����A��B�ĺϳ�·�ߣ�������ͼ��ʾ�����Լ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����������ԭ��Ӧ����
A��CaCO3+2HCl=CaCl2+CO2��+H2O
B��CaO+H2O=Ca(OH)2
C��2H2O2![]() 2H2O+O2��
2H2O+O2��
D��CaCO3![]() CaO+CO2��
CaO+CO2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com