
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,工业上生产亚氯酸钠和高氯酸的工艺流程如下:

已知:NaHSO4的溶解度随温度的升高而增大,适当条件下可结晶析出。请回答下列问题:
(1)NaClO2中氯元素的化合价为_________;某饱和NaCl溶液中含有CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是________。
(2)气体b是______(填化学式);无隔膜电解槽中阳极的电极反应式为___________。
(3)反应器I中发生反应的化学方程式为_________,冷却的目的是___________。
(4)反应器II中发生反应的离子方程式为________________。
(5)常温下,HClO2的电离平衡常数Ka=1.07×10-2,反应器II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中![]() =__________。
=__________。
【答案】 ⑴+3 ③②①⑤④(其他合理答案均可)
⑵H2 Cl--6e-+3H2O=ClO3-+6H+
⑶3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O 降低NaHSO4的溶解度,使NaHSO4结晶析出
⑷2ClO2+ SO2+4OH-=2ClO2-+ SO42-+2H2O
⑸1.07×1010
【解析】由工艺流程可知,在电解饱和食盐水时,阳极上溶液中的阴离子Cl-放电生成ClO3-,阴极上溶液中的阳离子H+放电生成H2.饱和食盐水经充分电解后得到氯酸钠溶液,在反应器I中,氯酸钠溶液经浓硫酸酸化发生了歧化反应,生成硫酸氢钠、二氧化氯和高氯酸。二氧化氯进入反应器II中被二氧化硫在碱性条件下还原得到亚氯酸钠。
(1). NaClO2中钠元素的化合价为+1价,氧元素的化合价为-2价,所以氯元素的化合价为+3;饱和NaCl溶液中含有CaCl2、MgCl2、Na2SO4等杂质,要制得纯净的食盐水,须除去钙离子、镁离子和硫酸根。除钙离子通常用碳酸钠溶液,除镁离子通常用氢氧化钠溶液,除硫酸根通常用氯化钡溶液,要想使杂质离子完全沉淀,所加除杂试剂必须过量一些,过量的氯化钡也得用碳酸钠溶液除去,所以碳酸钠溶液一定要在氯化钡溶液之后加入,待杂质离子完全沉淀后过滤,再向滤液中加入稀盐酸将过量的碳酸钠和氢氧化钠除去即完成了除杂。所以正确的操作顺序是③②①⑤④或 ③①②⑤④ 或②③①⑤④。
(2). 气体b是H2;无隔膜电解槽中阳极的电极反应式为Cl--6e-+3H2O=ClO3-+6H+ 。
(3). 反应器I中发生的反应是氯酸钠经浓硫酸酸化发生歧化反应生成HClO4、ClO2和3NaHSO4,化学方程式为3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O。因为NaHSO4的溶解度随温度的升高而增大,所以冷却的目的是降低NaHSO4的溶解度,使NaHSO4结晶析出。
(4).反应器II中发生的反应是二氧化氯被二氧化硫在碱性条件下还原得到亚氯酸钠,二氧化硫被氧化为硫酸根,离子方程式为2ClO2+ SO2+4OH-=2ClO2-+ SO42-+2H2O。
(5). )常温下,HClO2的电离平衡常数Ka=1.07×10-2,反应器II中反应所得NaClO2溶液中![]() =
=![]() =
=![]() =
= ![]() 1.07×10-2= 1.07×1010。
1.07×10-2= 1.07×1010。


科目:高中化学 来源: 题型:
【题目】吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断 Na2SeO3 的作用是
A.作氧化剂 B.作还原剂
C.既作氧化剂又作还原剂 D.既不作氧化剂又不作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
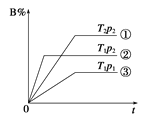
A.T1<T2 p1>p2 m+n>p 放热反应
B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应
D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于氮的固定的是( )
A.N2与H2在一定条件下反应生成NH3
B.NO和O2反应生成NO2
C.NH3经催化氧化生成NO
D.由NH3制NH4HCO3和(NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,将0.40 mol二氧化氮气体充入一个1 L抽空的密闭容器中,发生反应:2NO2![]() N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为_____________。
(2)该反应的平衡常数K的数值为___________(精确到0.1)。
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是______mol·L1。
(4)上述(3)达到平衡后N2O4的转化率为_______,混合气体的平均摩尔质量为____________。
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2![]() N2O4的平衡常数将________(填“增大”“减小”或“不变”)。
N2O4的平衡常数将________(填“增大”“减小”或“不变”)。
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将_____(填“向左移动”“向右移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列无色溶液中,能大量共存的一组是( )
A.Na+ Cu2+ Cl﹣ SO42﹣
B.Na+ Ca2+ CO32﹣ NO3﹣
C.Na+ H+ Cl﹣ NO3﹣
D.K+ H+ SO42﹣ OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列元素原子的最外层电子排布式,其中不能表示该元素一定为主族元素的是
A. 3s23p3 B. 4s2 C. 4s24p1 D. 3s23p5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硅的说法不正确的是
A. 晶体硅的导电性介于金属和绝缘体之间,是良好的半导体
B. 加热到一定温度时,硅能与氯气、氧气等非金属反应
C. 利用二氧化硅与C反应能制得粗硅
D. 二氧化硅是酸性氧化物, 不与任何酸反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com