
下列有关化学概念或原理的论述中,正确的是
| A.任何一个氧化还原反应都可以设计为电池,输出电能 |
| B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C.电解饱和食盐水的过程中,水的电离平衡正向移动 |
| D.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
科目:高中化学 来源: 题型:单选题
在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表.据此判断下列结论正确的是 ( )
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol/L) | 6 | 3 | 2 | 2 |
| c(B)/(mol/L) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol/L) | 1 | 2.5 | 3 | 3 |
 2C
2C查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是可逆反应X + Y  Z 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是 ( )
Z 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是 ( ) 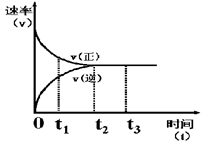
| A.t1时,正反应速率大于逆反应速率 |
| B.t2时,达到该条件下的最大反应限度 |
| C.t2- t3,反应不再发生,各物质的浓度相等 |
| D.t3后,该反应的反应限度有可能被外界条件改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一固定容积的密闭容器中,可逆反应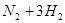
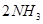 达到平衡的标志是( )。
达到平衡的标志是( )。
A.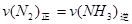 |
B.单位时间内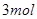 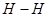 键断裂,同时6mol 键断裂,同时6mol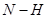 键断裂 键断裂 |
C.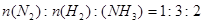 |
| D.反应混合物各组分的物质的量浓度还在改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)  ?2NH3(g) ΔH<0,反应过程如图:下列说法正确的是
?2NH3(g) ΔH<0,反应过程如图:下列说法正确的是
| A.t1 min时正、逆反应速率相等。 |
| B.X曲线表示NH3的物质的量随时间变化的关系 |
C.0~8 min,H2的平均反应速率v(H2)=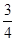 mol·L-1·min-1 mol·L-1·min-1 |
| D.10~12 min,升高温度使反应速率加快,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定条件下,反应N2+3H2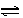 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
| A.v(H2)=0.03mol/(L·min) | B.v(N2)="0.005mol/(L·min)" |
| C.v(NH3)=0.17mol/(L·min) | D.v(NH3)=0.02mol/(L·min) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在2A + B =" 3C" + 4D的反应中,下列表示该反应速率最大的是
A.V(C)=0.5mol / (L·min) B.V(A)=0.8mol / (L·min)
C.V(B)=0.3mol / (L·min) D.V(D)=" 1mol" / (L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列选项中的图像所表示的内容与相应反应符合的是(a、b、c、d均大于0)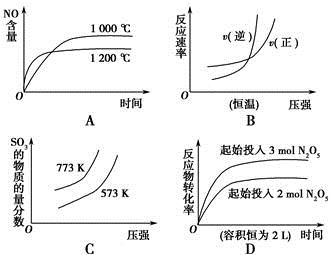
A.4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-a kJ·mol-1 4NO(g)+6H2O(g)ΔH=-a kJ·mol-1 |
B.N2(g)+3H2(g)  2NH3(g) ΔH=-b kJ·mol-1 2NH3(g) ΔH=-b kJ·mol-1 |
C.2SO3(g)  2SO2(g)+O2(g) ΔH=+c kJ·mol-1 2SO2(g)+O2(g) ΔH=+c kJ·mol-1 |
D.2N2O5(g)  4NO2(g)+O2(g) ΔH=+d kJ·mol-1 4NO2(g)+O2(g) ΔH=+d kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com