
| 化学键 | C═O(CO2) | C═O(COS) | C═S | H-S | H-O |
| E(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
分析 (1)反应①氢解反应:COS(g)+H2(g)═H2S(g)+CO(g)转移电子是2mol;②水解反应:COS(g)+H2O(g)═H2S(g)+CO2(g)的焓变等于旧键断裂吸收的能量和新键生成释放能量的差;
(2)①氢解反应:COS(g)+H2(g)═H2S(g)+CO(g)△H1=+7kJ/mol,②水解反应:COS(g)+H2O(g)═H2S(g)+CO2(g)△H2
②-①得到CO(g)+H2O(g)═CO2(g)+H2(g),根据盖斯定律计算反应的焓变;
(3)放热的、能自发的氧化还原反应可以设计成原电池;
(4)①金属储氢材料(MH)、白金(Pt)、硫酸溶液组成的原电池中,金属失电子发生氧化反应的电极是负极;
②原电池的正极上得电子的还原反应,据此书写电极反应;
③原电池的电流从正极流向负极,根据电极反应式确定电子转移情况.
解答 解:(1)反应①氢解反应:COS(g)+H2(g)═H2S(g)+CO(g)转移电子是2mol,吸热是7kJ;若某反应有4mol电子发生转移,则该反应吸收热量为14kJ,COS(g)+H2O(g)═H2S(g)+CO2(g)的焓变=(742+465×2)-(339+803)=-35kJ/mol,故答案为:14;-35;
(2)①氢解反应:COS(g)+H2(g)═H2S(g)+CO(g)△H1=+7kJ/mol,②水解反应:COS(g)+H2O(g)═H2S(g)+CO2(g)△H2=-35kJ/mol;
②-①得到CO(g)+H2O(g)═CO2(g)+H2(g),根据盖斯定律计算反应的焓变△H═-35kJ/mol-7kJ/mol=-42kJ/mol;
故答案为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-42kJ/mol;
(3)放热的、能自发的氧化还原反应可以设计成原电池;氢解反应是吸热反应,水解反应是非氧化还原反应,都不可以设计成原电池;
故答案为:否;氢解反应是吸热反应,水解反应是非氧化还原反应;
(4)①金属储氢材料(MH)、白金(Pt)、硫酸溶液组成的原电池中,金属失电子发生氧化反应的电极是负极,故答案为:MH;
②原电池的正极上得电子的还原反应,电极反应为:COS+2e-+2H+═CO↑+H2S,故答案为:COS+2e-+2H+═CO↑+H2S;
③原电池的电流从正极流向负极,金属失电子发生氧化反应的电极是负极,即电流的流动方向是Pt→MH,根据反应:COS+2e-+2H+═CO↑+H2S,当电路中有2mol电子流过时能够处理羰基硫(COS)1mol,标况下的体积是22.4L,故答案为:Pt;MH;22.4.
点评 本题考查学生热化学方程式的书写、盖斯定律的应用、焓变的计算以及原电池的工作原理知识,属于综合知识的考查,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
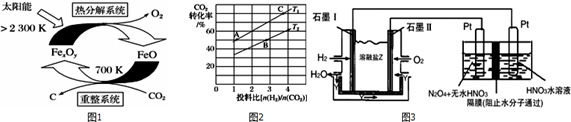
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
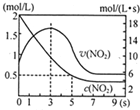 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题: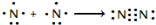 .
.| 化学键 | N-H | N-N | N═N | N≡N | O═O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种难溶电解质,Ksp小的溶解度一定小 | |
| B. | 0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-) | |
| C. | 在硫酸钡的沉淀溶解平衡体系中加入蒸馏水,硫酸钡的Ksp增大 | |
| D. | 用锌片作阳极,铁片作阴极,电解ZnCl2溶液,铁片表面出现一层锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
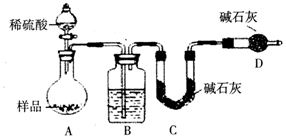
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com