
食盐是日常生活的必需品,也是重要的化工原料。
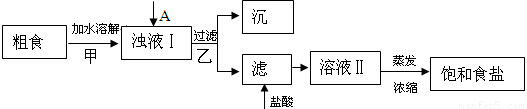
(1)粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
(1)①欲除去浊液Ⅰ中的Ca2+、Mg2+、SO42-,选出A所代表的试剂,按滴加顺序依次为 (只填化学式),检验溶液中SO42-沉淀完全的操作为 。
②加盐酸的目的是(用离子方程式表示) 。
③上述流程中,甲、乙两个过程均要用到玻璃棒,玻璃棒的作用分别是甲 ,乙 。
(2)工业上用惰性电极电解饱和食盐水法制取盐酸,写出电解饱和食盐水的化学方程式 ;用试纸检验电解食盐水阳极产物的方法是 。
(1)①BaCl2、NaOH 、Na2CO3或NaOH、BaCl2、Na2CO3
稍待片刻,待沉淀沉降完毕,上层出现清液,向上层清液中继续滴加氯化钡溶液,无沉淀生成,则沉淀完全。
②OH-+H+=H2O CO32-+2H+=H2O+CO2↑
③搅拌引流
(2)2NaCl+2H2O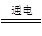 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
用湿润的蓝色石蕊试纸放在阳极区气体中,试纸先变红,后退色,证明有氯气生成(或用湿润的KI-淀粉试纸放在阳极区气体中,试纸变蓝色)
【解析】
试题分析:(1)沉淀Ca2+用Na2CO3溶液、沉淀Mg2+用NaOH溶液、沉淀SO42-用BaCl2溶液,但要注意除杂试剂必须过量且过量的试剂后续过程中需除去,所以试剂滴加的顺序是BaCl2、NaOH 、Na2CO3或NaOH、 BaCl2、Na2CO3。检验SO42-沉淀完全的操作方法为将浊液静置,向上层清液中继续滴加氯化钡溶液,无沉淀生成,说明SO42-完全沉淀;滤液中加盐酸的作用是除去过量的CO32-和OH-;溶解时用玻璃棒搅拌,加快溶解速度。过滤时用玻璃棒引流。
(2)电解饱和食盐水生成氢氧化钠、氢气和氯气;阳极产生氯气,可用湿润淀粉-KI试纸检验。
考点:化学实验 电解 元素及其化合物
点评:除杂时要注意试剂加入的顺序且所加试剂需过量,过量的试剂后续过程中需除去。


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
(1)炸油条时1 kg面粉需加入0.5 kg水,4 g明矾和10 g小苏打及少量食盐等辅料,经烹炸,成品油条的产率一般为80%,通过计算说明若每天食用100 g油条,则摄入铝的量是__________________。?
(2)请列举我国国民在日常生活中摄入铝(除食品添加剂外)的三种可能途径。______________________________________________________________________?
查看答案和解析>>
科目:高中化学 来源:0115 月考题 题型:填空题
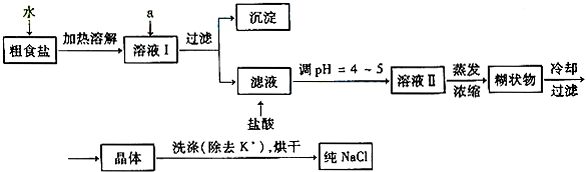
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com