
【题目】![]() 表示阿伏伽德罗常数,下列判断正确的是( )
表示阿伏伽德罗常数,下列判断正确的是( )
A.在18![]() 中含有NA个氧原子
中含有NA个氧原子
B.标准状况下,22.4L空气含有NA个单质分子
C.1 molCl2参加反应转移电子数一定为2NA
D.含![]() 个
个![]() 的
的![]() 溶解于1L水中,
溶解于1L水中,![]() 的物质的量浓度为1mol/L
的物质的量浓度为1mol/L
科目:高中化学 来源: 题型:
【题目】300mLAl2(SO4)3溶液中,含有Al3+为1.62 克,在该溶液中加入0.1mol/LBa(OH)2溶夜300ml,反应后溶液中SO42-的物质的量浓度约为
A. 0.4 mol/L B. 0.3 mol/L C. 0.1 mol/L D. 0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是一氧化碳和氢气的混合气,它由煤炭与水(蒸气)反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学方程式:___________________。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为:
C3H8(g)+ 5O2(g) ![]() 3CO2(g)+4H2O(l) ΔH=2 220.0 kJmol1
3CO2(g)+4H2O(l) ΔH=2 220.0 kJmol1
已知CO气体燃烧的热化学方程式为:
CO(g)+![]() O2 (g)
O2 (g)![]() CO2(g) ΔH=283.0 kJmol1。
CO2(g) ΔH=283.0 kJmol1。
试比较相同物质的量的C3H8和CO燃烧,产生的热量比值约为_________。
(3)已知氢气燃烧的热化学方程式为:2H2(g)+O2(g)![]() 2H2O(l) ΔH=571. 6 kJmol1。
2H2O(l) ΔH=571. 6 kJmol1。
试比较同质量的氢气和丙烷燃烧,产生的热量比值约为______。
(4)氢气是未来的能源,除产生的热量大之外,还具有的优点是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾是对大气中各种悬浮颗粒物含量超标的笼统表述,但雾和霾的区别很大。雾是由大量悬浮在近地面空气中的微小水滴或冰晶组成的气溶胶系统,属于自然现象。霾是空气中的灰尘、硫酸、硝酸等颗粒物组成的气溶胶系统造成视觉障碍,属于大气污染。如图为霾的主要成分示意图。下列说法不正确的是
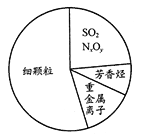
A. 汽车尾气的大量排放是造成雾霾天气的人为因素之一
B. 雾天开车时,汽车车灯的光束在雾中能产生丁达尔效应
C. 苯、甲苯、二甲苯都属于芳香烃
D. SO2和NxOy都属于酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“氢能”是未来最理想的新能源。
(1)实验测得,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为_________。(填序号)
A.2H2 (g)+ O2 (g)![]() 2H2O(l) ΔH =142.9 kJ mol1
2H2O(l) ΔH =142.9 kJ mol1
B.H2 (g)+![]() O2 (g)
O2 (g)![]() H2O(l) ΔH=285.8 kJ mol1
H2O(l) ΔH=285.8 kJ mol1
C.2H2 + O2![]() 2H2O (l) ΔH= 571.6 kJ mol1
2H2O (l) ΔH= 571.6 kJ mol1
D.H2 (g)+![]() O2 (g)
O2 (g)![]() H2O(g) ΔH=285.8 kJ mol1
H2O(g) ΔH=285.8 kJ mol1
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
① CaBr2 +H2O![]() CaO+2 HBr
CaO+2 HBr
② 2HBr+Hg![]() HgBr2 + H2↑
HgBr2 + H2↑
③ HgBr2 +_________![]() _________
_________
④ 2HgO![]() 2Hg+O2↑
2Hg+O2↑
⑤2H2 + O2![]() 2H2O
2H2O
请你根据“原子经济”的思想完成上述步骤③的化学方程式:___________。并根据“绿色化学”的思想评估该方法制H2的主要缺点:_________。
(3)利用核能把水分解制氢气,是目前正在研究的课题。如图是其中的一种流程,其中用了过量的碘。

完成下列反应的化学方程式:反应①____________________;反应②______________________。此法制取氢气的最大优点是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种安全无毒的物质,带有结晶水,通常还含有CaO。经审查,面粉中添加过氧化钙已无技术上的必要性,因此,卫生部严令禁止在面粉生产中添加等添加剂。但过氧化钙在工农业生产中广泛用作杀菌剂、防腐剂、解酸剂、油类漂白剂等。
(1)称取5.42 g过氧化钙样品,灼热时发生如下反应:
2[CaO2·xH2O] → 2CaO + O2↑+ 2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为________。
(2)另取同一样品5.42 g,溶于适量稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 7.0 g。
①样品中CaO的质量为________。
②样品中CaO2·xH2O中的x值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组需要480 mL 0.1000 mol/L的NaOH溶液。欲在实验室用固体烧碱配制。请回答下列问题:

(1)本实验需用托盘天平称量烧碱的质量为_____g。
(2)配制过程中,不需要的仪器(填写代号)________________。
a.烧杯 b.冷凝管 c.玻璃棒 d.1000mL容量瓶 e.漏斗 f.胶头滴管
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的仪器有药匙、___、___。
(4)请说出本实验中玻璃棒的作用____________。
(5)将上图中的实验步骤A~F按实验过程先后次序排列______________。
(6)请用恰当的文字描述上图A操作的过程____________________________。
(7)若配制过程中,其他操作都准确,下列操作能引起浓度偏高的有______(填代号)。
①用来溶解NaOH的烧杯里面有少许水
②未等稀释后的NaOH溶液冷却至室温就转移到容量瓶中
③将NaOH溶液转移到容量瓶时,不小心撒到了外面少许
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com