
| A. | ①与②比较:c(Na+)>c(NH4+) | |
| B. | ①中的离子浓度的大小关系是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 向③中加入适量醋酸溶液,使溶液pH=7,则:c(CH3COO-)>c(Na+) | |
| D. | ①与②等体积混合的溶液中:c(Cl-)=c(NH4+)+c(Na+)+c(NH3•H2O) |
分析 A.氯化铵溶液中,铵根离子部分水解,铵根离子浓度减小;
B.氯化铵溶液中,铵根离子水解,溶液显示酸性,c(Cl-)>c(NH4+)、c(H+)>c(OH-);
C.溶液的pH=7,溶液显示中性,则c(H+)=c(OH-),根据电荷守恒可知c(CH3COO -)=c(Na+);
D.溶液中满足物料守恒,根据混合液中的物料守恒进行判断.
解答 解:A.①氯化铵溶液中,铵根离子部分水解,则c(NH4+)<0.1mol/L,而②氯化钠溶液中,c(Na+)=0.1mol/l,则c(Na+)>c(NH4+),故A正确;
B.①氯化铵溶液中,铵根离子部分水解,则溶液中c(Cl-)>c(NH4+),溶液显示酸性,则c(H+)>c(OH-),溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B正确;
C.③中滴加适量醋酸溶液,使溶液pH=7,溶液显示中性,则c(H+)=c(OH-),根据电荷守恒c(CH3COO -)+c(OH-)=c(Na+)+c(H+)可知:c(CH3COO -)=c(Na+),故C错误;
D.①氯化铵、②氯化钠等体积混合后,体积增大1倍,则溶液中c(Cl-)=0.1mol/L,c(Na+)=0.05mol/L,c(NH4+)+c(NH3•H2O)=0.05mol/L,则c(Cl-)=c(Na+)+c(NH4+)+c(NH3•H2O),故D正确;
故选C.
点评 本题考查了溶液中离子浓度大小比较,题目难度中等,注意掌握盐的水解原理,能够根据电荷守恒、物料守恒、盐的水解原理判断溶液中各离子浓度大小.


科目:高中化学 来源: 题型:选择题
| A. | a、b试管中液体不分层,溶液均为无色 | |
| B. | c、d试管中液体分层,c试管中有机层在下,呈红棕色;d试管中有机层在上,呈红棕色 | |
| C. | a试管中有机层在下,为无色,水层在上,为无色;d试管中有机层在下,呈红棕色 | |
| D. | 以上描述均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Vl=V2,且混合溶液pH<7,则必有c1<c2 | |
| B. | 若混合溶液的pH=7,则混合溶液中c(Na+)=c (CH3COO-)+c(CH3COOH ) | |
| C. | 若混合溶液的pH>7,则混合溶液中c(Na+)<c( CH3COO-) | |
| D. | 若Vl=V2,c1=c2,则混合溶液中c(OH-)=c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液 | B. | 石蕊试液 | ||
| C. | 含酚酞的氢氧化钠溶液 | D. | 淀粉碘化钾试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
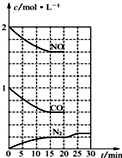 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑦⑧⑨⑩ | B. | ①②③⑤⑧⑨ | C. | ②⑤⑥⑦⑧ | D. | ②④⑦⑧⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入用盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| D | 向少量某物质的稀溶液中滴加稀盐酸,产生了能使澄清石灰水变浑浊的气体 | 该物质一定是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com