
在下列平衡:2CrO42-(黄色)+ 2H+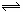 Cr2O72-(橙红色)+ H2O中,溶液介于黄和橙红色之间,今欲增加溶液的橙红色,则要在溶液中加入( )
Cr2O72-(橙红色)+ H2O中,溶液介于黄和橙红色之间,今欲增加溶液的橙红色,则要在溶液中加入( )
A.H2O B.OH- C.K+ D. H+
科目:高中化学 来源: 题型:
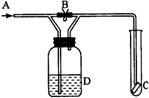
如右图是一种试验某气体化学性质的实验装置,图中B为止水夹。如先打开B,在A处通入干燥氯气,C中红布条颜色无变化;当关闭B时,C中红布条颜色褪去。则D瓶中盛有的溶液是( )。
A.浓硫酸 B.浓NaOH溶液 C.四氯化碳 D.饱和NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①2C (s) + O 2(g) = 2CO (g) △H =-221.0 kJ/mol
②C (s) + O 2(g) = CO2 (g) △H =-393.51kJ/mol
计算反应C (s) + CO2 (g) = 2CO (g)的反应热△H为( )
A.+172.51 kJ/mol B. -283.01 kJ/mol
C. +283.01 kJ/mol D.+504.00 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
反应C ( s) + H2O (g) 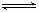 CO ( g) + H2 (g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO ( g) + H2 (g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.升高温度
B. 将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D. 保持压强不变,充入N2 使容器体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如图所示的装置。
(1)检查图所示装置气密性的方法是________________________________________________。
(2)分别写出Al和Fe与硫酸反应的离子方程式
_____________________________ , _______________________。
(3)若要比较产生气体的快慢,可以测量相同时内产生气体的体积,也可以测量________________________________________。
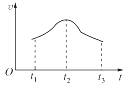 (4)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图所示,分析不同时间段速率变化的原因:
(4)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图所示,分析不同时间段速率变化的原因:
t1─t2 阶段速率加快的原因________________________。
t2─t3 阶段速率减慢的原因_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数, 下列说法正确的是( )
A. 常温常压下,0.1NA个HCl分子的体积为2.24L
B. 标准状况下,22.4L 氖气含有2NA 个原子
C. 1L 0.2mol/L 硫酸铁溶液中含有的SO42- 离子数目为0.2 NA
D. 1 mol氖中含有的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一定量含有Na2O杂质的Na2O2试样,现从图中选用适当的装置,设计一个最简单的实验,测定Na2O2试样的纯度(可供选用的反应物有CaCO3、约18%的盐酸和水)。
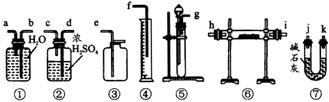
请填写下列空白:
(1)写出在实验中Na2O2和Na2O分别发生反应的化学方程式________,________。
(2)应选用装置(只要求写图中装置的标号)________。
(3)所选装置的连接顺序是(填各接口的字母,连接胶管省略)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com