
2010年4月,科学家成功合成了一种拥有117个质子的新元素。科学家用 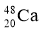 轰击
轰击 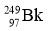 ,生成了6个拥有117个质子的新原子,其中的5个原子有176个中子,1个原子有177个中子。下列有关说法正确的是( )
,生成了6个拥有117个质子的新原子,其中的5个原子有176个中子,1个原子有177个中子。下列有关说法正确的是( )
A.第117号元素是副族元素
B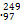 Bk的质量数为97
Bk的质量数为97
C.第117号元素是非金属元素
D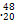 Ca2+的中子数比核外电子数多10
Ca2+的中子数比核外电子数多10
科目:高中化学 来源:2014高考化学二轮专题突破 专题七化学反应与能量练习卷(解析版) 题型:选择题
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见 ( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为NH4HCO3+HCl―→NH4Cl+CO2↑+H2O ΔH=+Q kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题7电解质溶液练习卷(解析版) 题型:填空题
(1)常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合液的pH=8。混合液中由水电离出的OH-浓度与0.1 mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为 。
(2)相同温度下,将足量硫酸钡固体分别放入相同体积的①0.1 mol·L-1硫酸铝溶液;②0.1 mol·L-1氯化钡溶液;③蒸馏水;④0.1 mol·L-1硫酸溶液中,Ba2+浓度由大到小的顺序是 (用序号填写)。
(3)常温下,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合,当溶液中c(N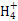 )=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb= 。
)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb= 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
煤气是生活中常用的燃料,制取水煤气的反应为C(s)+H2O(g) CO(g)+H2(g)。该反应在一容积可变的密闭容器中进行时,改变下列条件会对反应速率产生影响的是( )
CO(g)+H2(g)。该反应在一容积可变的密闭容器中进行时,改变下列条件会对反应速率产生影响的是( )
①增加碳的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使体系体积增大
A.①② B.②③ C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题5物质结构 元素周期律练习卷(解析版) 题型:选择题
已知X、Y、Z、W、R五种元素,原子序数依次增大,且原子序数都小于20,X元素的原子是所有元素的原子中半径最小的,Y、W同主族,Z、W同周期,Y元素原子的最外层电子数是次外层的3倍,Z、R分别是同周期中金属性最强的元素。下列说法不正确的是( )
A.沸点:X2Y>X2W
B.由X、Y、Z、W四种元素组成的化合物既含有共价键又含离子键
C.原子半径:X<Y<Z<W<R
D.Y与W形成的化合物WY2是形成酸雨的主要物质之一
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题4化学反应中的能量变化练习卷(解析版) 题型:选择题
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2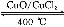 2Cl2+2H2O
2Cl2+2H2O
已知:Ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
Ⅱ.
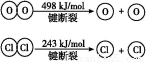
判断下列说法正确的是( )
A.反应A的ΔH>-115.6 kJ/mol
B.断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为32 kJ
C.H2O中H—O键比HCl中H—Cl键弱
D.由Ⅱ中的数据判断氯元素的非金属性比氧元素强
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题3氧化还原反应 离子反应练习卷(解析版) 题型:填空题
Ⅰ.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是 。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2 6CaSiO3+P4O10
6CaSiO3+P4O10
10C+P4O10 P4+10CO
P4+10CO
每生成1 mol P4时,就有 mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2 C6H6O6+2H++2I-
C6H6O6+2H++2I-
2S2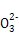 +I2
+I2 S4
S4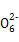 +2I-
+2I-
在一定体积的某维生素C溶液中加入a mol/L I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol/L Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是 mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2I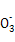 +5S
+5S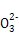 +2H+
+2H+ I2+5S
I2+5S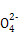 +H2O
+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
| 0.01 mol/LKIO3酸性溶液(含淀粉)的体积/mL | 0.01 mol/LNa2SO3溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s |
实验1 | 5 | V1 | 35 | 25 |
|
实验2 | 5 | 5 | 40 | 25 |
|
实验3 | 5 | 5 | V2 | 0 |
|
该实验的目的是 ;表中V2= mL。
Ⅱ.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是 。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++ H2O2+ H2O Ce(OH)4↓+ 。
Ce(OH)4↓+ 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题2化学常用计量 溶液练习卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.24 g NaH中阴离子所含电子总数为NA
B.标准状况下,22.4 L苯中含有C—H键数目为6NA
C.在碳酸钠溶液中,若c(C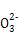 )=1 mol/L,则c(Na+)=2 mol/L
)=1 mol/L,则c(Na+)=2 mol/L
D.通过MnO2催化使H2O2分解,产生32 g O2时转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题12化学实验基本操作与方案设计练习卷(解析版) 题型:选择题
下列使用漏斗的几个实验装置中,设计正确且能达到实验目的的是( )
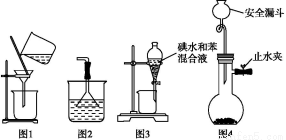
A.用图1所示装置进行过滤,过滤时不断搅拌
B.用图2所示装置吸收NH3制氨水
C.用图3所示装置用苯萃取碘水中的碘,并把碘的苯溶液从漏斗下口放出
D.用图4所示装置用石灰石与稀盐酸制取CO2气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com