
��1���̶�������CO2����Ч��������Դ�������ٿ����е��������塣��ҵ����һ����CO2�������״�ȼ�ϵķ�����CO2(g)��3H2(g)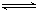 CH3OH(g)��H2O(g)��H����49��0kJ��mol��1��ij��ѧʵ�齫6molCO2��8molH2����2L�ܱ������У����H2�����ʵ�����ʱ��仯����ͼ��ʾ��ʵ�ߣ���ͼ������a��1��6����������˼�ǣ���l minʱH2�����ʵ�����6mol��
CH3OH(g)��H2O(g)��H����49��0kJ��mol��1��ij��ѧʵ�齫6molCO2��8molH2����2L�ܱ������У����H2�����ʵ�����ʱ��仯����ͼ��ʾ��ʵ�ߣ���ͼ������a��1��6����������˼�ǣ���l minʱH2�����ʵ�����6mol��
������ʱ���ƽ����Ӧ����������__________����С����______________��
A��0��1min B��1��3min C��3��8min D��8��11min
�ڽ��ı�ijһʵ�������ٽ�������ʵ����H2�����ʵ�����ʱ��仯��ͼ��������ʾ�����ߢ��Ӧ��ʵ��ı��������________�����ߢ��Ӧ��ʵ��ı��������_________��
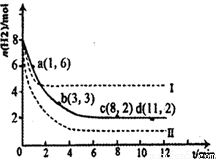
��2�����ù��ܺ�������ɽ�CO2��H2O(g)ת��ΪCH4��O2�����������ʱ��������CO2��H2O(g)�ڲ�ͬ����(��)�����£�CH4���������ʱ��ı仯��ͼ��ʾ����0~30 h�ڣ�CH4��ƽ����������v(��)��v(��)��v(��)�Ӵ�С��˳��Ϊ ����Ӧ��ʼ���12Сʱ�ڣ��ڵ�___________�ִ����������£��ռ���CH4��ࡣ
��12�֣���1����A��D �������¶ȣ�����ѹǿ����������CO2Ũ�ȣ���2�֣�
��2��v(��)>v(��)>v(��)��2�֣�;�� ��2�֣�
��������
�����������1������ͼ1��֪��0��1min�������ı仯��Ϊ8mol-6mol=2mol��
B��1��3min�������ı仯��Ϊ6mol-3mol=3mol��ƽ��1min�仯��Ϊ1.5mol��
C��3��8min�������ı仯��Ϊ3mol-2mol=1mol��ƽ��1min�仯��Ϊ0.2mol��
D��8��11min��ƽ��״̬�����������ʵ������ٱ仯��
��1��3min��������8��11min��������
�ʴ�Ϊ��A��D��
�ڶ��ڿ��淴ӦCO2��g��+3H2��g�� CH3OH��g��+H2O��g����H=-49.0kJ��mol��1������Ӧ�������С�ķ��ȷ�Ӧ��
CH3OH��g��+H2O��g����H=-49.0kJ��mol��1������Ӧ�������С�ķ��ȷ�Ӧ��
��ͼ1��֪�����ߢ����ȵ���ƽ�⣬ƽ��ʱ���������ʵ������ʸı�����Ӧ����Ӧ������ƽ�����淴Ӧ�ƶ������Բ�ȡ�Ĵ�ʩΪ�������¶ȣ�
���ߢ�ƽ���ʱ���ԭƽ��̣�ƽ��ʱ���������ʵ�����С���ʸı�����Ӧ����Ӧ������ƽ��������Ӧ�ƶ������Բ�ȡ�Ĵ�ʩΪ������ѹǿ����������CO2Ũ�ȣ�
�ʴ�Ϊ�������¶ȣ�����ѹǿ����������CO2Ũ�ȣ�
��2����ͼ2��֪����0��30h�ڣ���������ʵ����仯��Ϊ��n������n������n��������0��30h�ڣ�CH4��ƽ����������v����v����v����
��ͼ2��֪��Ӧ��ʼ���12Сʱ�ڣ��ڵڢ��ִ����������£��ռ���CH4��࣮
�ʴ�Ϊ��v����v����v������
���㣺���ʵ�����Ũ����ʱ��ı仯���ߣ���Ӧ���ʵĶ�����ʾ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

 ͨ����ȥ��Ӧ�Ʊ���Ļ�ѧ����ʽΪ
ͨ����ȥ��Ӧ�Ʊ���Ļ�ѧ����ʽΪ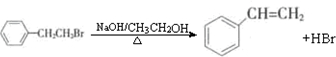
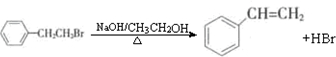


 ����дһ�֣�
����дһ�֣� ����дһ�֣�
����дһ�֣� ��H2���߷�����Ӧ�����������뷴Ӧ�������ɻ�������͢��������ʽ��ΪC9H8O���Ҷ��ܷ���������Ӧ�����й��ڢ��͢���˵����ȷ����
��H2���߷�����Ӧ�����������뷴Ӧ�������ɻ�������͢��������ʽ��ΪC9H8O���Ҷ��ܷ���������Ӧ�����й��ڢ��͢���˵����ȷ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| T/��K�� | 298 | 398 | 498 | �� |
| K/��mol?L-1��-2 | 4.1��106 | K1 | K2 | �� |
2- 4 |
+ 4 |
+ 4 |
2- 4 |
+ 4 |
2- 4 |
+ 4 |
2- 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2013?������ģ����ҵ�ϡ��̶���������CO2����Ч�ؼ��ᡰ����ЧӦ����
��2013?������ģ����ҵ�ϡ��̶���������CO2����Ч�ؼ��ᡰ����ЧӦ����| ���ʵĻ�ѧʽ | CH3COOH | H2CO3 | |
| ����ƽ�ⳣ�� | K=1.8��10-5 | K1=4.3��10-7 | K2=5.6��10-11 |
| c(CH3COO-) |
| c(CH3COOH) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
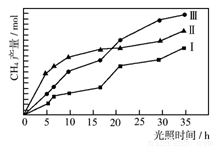
��12�֣��̶�������CO2����Ч��������Դ�������ٿ����е��������壮CO2�뻯����A��Ӧ���ɻ�����B�����·�Ӧʽ�������Լ������P��Ӧ������ʡ�ԣ���
��1��������B�ķ���ʽΪ__________��1 mol��������ȫȼ��������_________mol O2��
��2����ͨ����ȥ��Ӧ�Ʊ�A�Ļ�ѧ����ʽΪ(ע����Ӧ����)��
_______________________________________________________________________��
��3��B�����C2H5OH������·���������Ӧ�����ɵ��л���Ľṹ��ʽΪ��
__________________________________________��
��4����CO2���ƣ�COҲ�ܱ��̶������á���һ�������£�CO����
H2���߷�����Ӧ�����������뷴Ӧ�������ɻ�����C�ķ���ʽΪC9H8O��������C�ܷ���������Ӧ��д��������C���ܵĽṹ��ʽ��
___________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�긣��ʡ����͡һ�и߶���ѧ����ĩ������ѧ���� ���ͣ������
��12�֣��̶�������CO2����Ч��������Դ�������ٿ����е��������壮CO2�뻯����A��Ӧ���ɻ�����B�����·�Ӧʽ�������Լ������P��Ӧ������ʡ�ԣ���

��1��������B�ķ���ʽΪ__________��1 mol��������ȫȼ��������_________mol O2 ��
��2���� ͨ����ȥ��Ӧ�Ʊ�A�Ļ�ѧ����ʽΪ(ע����Ӧ����)��
ͨ����ȥ��Ӧ�Ʊ�A�Ļ�ѧ����ʽΪ(ע����Ӧ����)��
_______________________________________________________________________��
��3��B�����C2H5OH������·���������Ӧ�����ɵ��л���Ľṹ��ʽΪ��
__________________________________________��
��4����CO2���ƣ�COҲ�ܱ��̶������á���һ�������£�CO��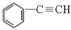 ��
��
H2���߷�����Ӧ�����������뷴Ӧ�������ɻ�����C�ķ���ʽΪC9H8O��������C�ܷ���������Ӧ��д��������C���ܵĽṹ��ʽ��
___________________________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com