
| A、H2O |
| B、Na2O |
| C、NH4Cl |
| D、N2 |


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
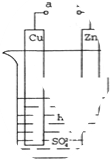 原电池是化学对人类的一项重大贡献.
原电池是化学对人类的一项重大贡献.查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K1 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 起始浓度 | 甲 | 乙 | 丙 |
| c(CO2)(mol?L-1) | 0.01 | 0.02 | 0.02 |
| c(H2)(mol?L-1) | 0.01 | 0.01 | 0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Cl2通入含1molFeBr2的溶液中 Cl2+Fe2++2Br-=Fe3++Br2+2Cl- | ||
B、少量的NaHSO4加到足量的Ba(OH)2溶液中 H++S
| ||
C、少量的石灰水加到足量的NaHCO3溶液中 Ca2++OH-+HC
| ||
| D、氧化铜与盐酸反应 O2-+2H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解过程中共消耗2amol水 | ||
| B、剩余溶液中有大量蓝色沉淀产生 | ||
C、剩余溶液中溶质的质量分数为
| ||
D、剩余溶液中溶质的质量分数为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、固态物质一定是晶体 |
| B、冰和固体碘晶体中的相互作用力相同 |
| C、晶体内部的粒子按一定规律周期性的排列 |
| D、凡有规则外形的固体一定是晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com