
分析 (1)①当正逆反应速率不相等时,化学平衡会向着正方向或是逆方向进行;升温,化学反应速率加快,平衡向吸热方向移动,即逆方向移动;
②燃料电池的负极失去电子发生氧化反应,一氧化碳失去电子,化合价升高,被氧化成二氧化碳,二氧化碳与电解质溶液氢氧化钾反应生成碳酸钾和水;
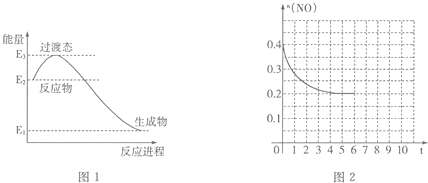
(2)①根据能量变化图,反应热=生成物具有的能量-反应物具有的能量,再根据热化学反应方程式的书写解答;
②第6分钟继续加入0.2molNO、0.2molCO、0.2molCO2和0.3molN2,根据Qc=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$计算,然后比较Qc与K的大小关系判断移动方向,再作图;
(3)NaCN是强碱弱酸盐,CN-水解后呈碱性,CN-+H2O?HCN+OH-,计算水解平衡常数Kh,再根据Ka=$\frac{{K}_{w}}{{K}_{h}}$计算.
解答 解:(1)①化学平衡的标志是正逆反应速率相等,当逆反应速率大于正反应速率时,说明反应是逆向进行的,CO(g)+2H2(g)?CH3OH(g)△H<0;改变条件,既能同时增大正、逆反应速率又能使平衡逆向移动的措施是:升高温度,化学反应速率加快,平衡向吸热方向移动,即逆方向移动,
A.正反应速率先增大后减小,说明反应正向进行,故A正确;
B.平衡逆向进行氢气的转化率减小,故B错误;
C.化学平衡常数K值增大,说明平衡正向进行,故C正确;
D.反应物的体积百分含量增大,可能逆向进行,也可能正向进行,不能说明反应正向进行,故D错误;
故答案为:AC;升高温度;
②燃料电池的负极失去电子发生氧化反应,一氧化碳失去电子,化合价升高,被氧化成二氧化碳,二氧化碳与电解质溶液氢氧化钾反应生成碳酸钾和水,电极反应式为:CO-2e-+4OH-=CO32-+2H2O,
故答案为:CO-2e-+4OH-=CO32-+2H2O;
(2)①一定条件下H2还原NO生成N2和1mol水蒸气,依据能量变化图可知反应放热,反应焓变△H=E1-E2,反应热与反应物计量数成正比关系,
所以该热化学方程式为:2H2(g)+2NO(g)=N2(g)+2H2O (g)△H=2(E1-E2)kJ•mol-1,
故答案为:2H2(g)+2NO(g)=N2(g)+2H2O (g)△H=2(E1-E2)kJ•mol-1;
②已知反应为2NO(g)+2CO(g)?N2(g)+2CO2(g),2L密闭容器中充入NO、CO各0.4mol,达到平衡时NO为0.2mol,
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始(mol):0.4 0.4 0 0
转化(mol):0.2 0.2 0.1 0.2
平衡(mol):0.2 0.2 0.1 0.2
则K=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$=$\frac{\frac{0.1mol}{2L}×(\frac{0.2mol}{2L})^{2}}{(\frac{0.2mol}{2L})^{2}×(\frac{0.2mol}{2L})^{2}}$=5;
第6分钟继续加入0.2molNO、0.2molCO、0.2molCO2和0.3molN2,则c(NO)=(0.2mol+0.2mol)÷2L=0.2mol/L,c(CO)=(0.1mol+0.3mol)÷2L=0.2mol/L,
c(N2)=(0.1mol+0.3mol)÷2L=0.2mol/L,c(CO2)=(0.2mol+0.2mol)÷2L=0.2mol/L,
Qc=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$=$\frac{0.2×0.{2}^{2}}{0.{2}^{2}×0.{2}^{2}}$=5=K,说明是平衡状态,所以第6分钟继续加入0.2molNO、0.2molCO、0.2molCO2和0.3molN2,仍是平衡状态,但是NO的物质的量变为原来的2倍,作图为 ;
;
故答案为: ;
;
(3)NaCN是强碱弱酸盐,CN-水解后呈碱性,CN-+H2O?HCN+OH-,常温下,0.1mol/L的NaCN溶液pH为11.0,故Kh=$\frac{c(O{H}^{-})×c(HCN)}{c(C{N}^{-})}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1-1{0}^{-3}}$=10-5,则HCN的电离常数Ka=$\frac{{K}_{w}}{{K}_{h}}$=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9,
故答案为:CN-+H2O?HCN+OH-;10-9.
点评 本题考查化学反应速率与化学平衡移动问题,化学平衡常数及影响因素、意义,反应热的计算等,难度中等,本题注意分析图象曲线的变化趋势,侧重于考查学生的读图能力和分析能力,注意利用盐的水解平衡常数和水的离子积常数换算.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 液态氟化氢中存在氢键,所以其分子比氯化氢更稳定 | |
| B. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| C. | 能形成+7价含氧酸及其盐的元素一定属于主族元素 | |
| D. | 原子最外层电子数等于6的元素一定属于主族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某小组为研究电化学原理,设计如图装置.回答下列问题:
某小组为研究电化学原理,设计如图装置.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Na2O2与足量CO2反应转移的电子数目为0.1 NA | |
| B. | 标准状况下,2.24 L CCl4中的分子数目为0.1 NA | |
| C. | 0.1 mol•L-1NaOH溶液中Na+的数目为0.1 NA | |
| D. | 3.2 g O2和O3的混合物含有的分子数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价 | |
| B. | 用水作电解质溶液 | |
| C. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| D. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑦⑧ | B. | ②③④⑦⑧ | C. | ②③④⑥⑧ | D. | ③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
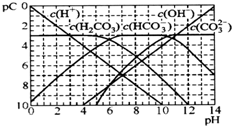
| A. | H2CO3、HCO3-、CO32-不能在同一溶液中大量共存 | |
| B. | H2CO3电离平衡常数Kal≈10-6 | |
| C. | pH=7时,溶液中存在关系(HCO3-)>c(H2CO3)>c(CO32-) | |
| D. | pH=9时,溶液中存在关系(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com