
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
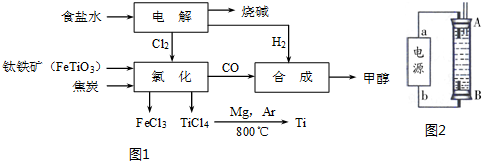
分析 (1)①根据浓度熵数值和平衡常数的大小关系来判断;
②从图示可知氯化时的反应物、生成物,再根据得失电子和原子守恒即可得出该反应的方程式;
③根据CO和H2合成甲醇的方程式:CO(g)+2H2(g)?CH3OH(g)以及2FeTiO3+6C+7Cl2$\frac{\underline{\;通电\;}}{\;}$2FeCl3+2TiCl4+6CO和2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑得到相应关系式来计算;
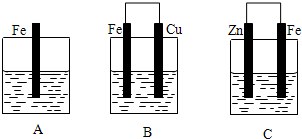
(2)①根据C3H8和O2构成丙烷燃料电池,负极丙烷失去电子生成二氧化碳气体;
②A、B端析出氢气可驱赶原溶液中溶解的少量氧气;
B、电解液选用NaCl溶液不影响实验,因为阳极是铁失电子生成亚铁离子,溶液中的阴离子不放电;
C、阳极应该用铁电极,阴极用惰性电极亦可;
D、B电极反应是阴极氢离子放电生成氢气;
(3)①比较第二组的第一组反应物的转化率大小以及温度对化学平衡和转化率的影响来判断;
②首先利用三段式计算出平衡时各物质的浓度,根据K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$计算;
③实验3跟实验2相比,温度相同,浓度相同,但实验3达到平衡所用时间少,反应速率更大,但平衡状态没有发生移动.
解答 解:(1)①将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此状态的浓度熵Qc=$\frac{1}{1×1.{5}^{2}}$=0.44>0.27,即Qc>K,所以此时反应将向逆反应方向进行,
故答案为:向逆反应方向进行;
②从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为:2FeTiO3+6C+7Cl2$\frac{\underline{\;通电\;}}{\;}$2FeCl3+2TiCl4+6CO,
故答案为:2FeTiO3+6C+7Cl2$\frac{\underline{\;通电\;}}{\;}$2FeCl3+2TiCl4+6CO;
③由方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;通电\;}}{\;}$2FeCl3+2TiCl4+6CO和2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑得如下关系式:
6CH3OH→6CO→7Cl2→7H2,而6CH3OH→12H2,故每生产6molCH3OH(192g)需额外补充5molH2(10g),则生产38.4t甲醇,至少需额外补充氢气的质量为:$\frac{38.4×1{0}^{3}g}{192g}$×5×2g/mol=2.0t,
故答案为:2.0t;
(2)①C3H8和O2构成丙烷燃料,电解质溶液为硫酸,则负极丙烷失去电子生成二氧化碳气体,负极的电极反应式为:C3H8-20e-+6H2O=3CO2+20H+,
故答案为:C3H8-20e-+6H2O=3CO2+20H+;
②A.因为生成的氢气将装置中原有氧气溢出,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子,电源中的a与A相连,则a为正极,b与B相连,则b为负极,故A正确;
B.电解池中阳极是铁失去电子发生氧化反应生成亚铁离子,阴极是溶液中的氢离子得电子发生还原反应,所以电解质溶液中的阴离子不会在阳极失电子,所以选用NaCl溶液不影响实验,故B正确;
C.阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,故C错误;
D.阴极氢离子放电,其电极反应为2H++2e-=H2↑,故D正确;
故答案为:ABD;
(3)①实验1中CO的转化率为:$\frac{1.6mol}{4mol}$×100%=40%,实验2中CO的转化率为:$\frac{0.4mol}{2mol}$×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,
故答案为:放;
②H2O(g)+CO(g)?CO2(g)+H2(g)
初始 1mol/L 2mol/L 0 0
转化0.4mol/L 0.4mol/l 0.4mol/l 0.4mol/l
平衡0.6mol/L 1.6mol/L 0.4mol/l 0.4mol/l
根据K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$=$\frac{0.4×0.4}{0.6×1.6}$=$\frac{1}{6}$,
故答案为:$\frac{1}{6}$;
③实验3跟实验2相比,温度相同,浓度相同,但实验3达到平衡所用时间少,反应速率更大,但平衡状态没有发生移动,应是使用了催化剂,又由于反应前后气体体积不变,则增大了压强,平衡也不移动,也可能为压强的增大,
故答案为:使用了催化剂或增大了压强.
点评 本题考查物质分离与提纯方法、化学平衡、原电池原理等在,题目难度中等,做题时注意把握影响平衡移动的因素以及平衡常数的有关计算方法,明确原电池工作原理,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 放热反应不需要加热就能发生 | |
| C. | 吸热反应在一定条件(如常温、加热等)也能发生 | |
| D. | 化学反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对高低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
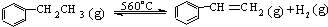 △H>0
△H>0| A. | 在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率 | |
| B. | 在保持压强一定的条件下,充入不参加反应的气体,有利于提高苯乙烯的产率 | |
| C. | 在加入乙苯至达到平衡过程中,混合气体的平均相对分子质量在不断增大 | |
| D. | 不断分离出苯乙烯可加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 世博会期间,处理废水时加入明矾可作为混凝剂以吸附水中的悬浮物杂质且有杀菌消毒的作用 | |
| B. | 世博会期间,利用可降解的“玉米塑料”替代一次性饭盒,可防止产生白色污染 | |
| C. | 世博会中国馆--“东方之冠”使用了大量钢筋混凝土,混凝土是混合物 | |
| D. | 世博停车场安装光电设施,可将阳光转化为电能以供应照明 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com