
羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸在一定的条件下反应制得。
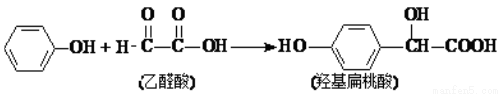
下列有关说法正确的是( )
A.该反应是取代反应
B.苯酚和羟基扁桃酸遇上 FeCl3溶液都会显色
C.乙醛酸与 H2加成的产物能在催化剂作用下形成高分子化合物
D.1 mol 羟基扁桃酸能与3mol NaOH 反应
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源:2015-2016学年江西省高一下学期期中考试化学试卷(解析版) 题型:选择题
干电池原理示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )
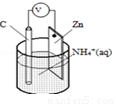
A.碳为电池的负极
B.Zn极上发生氧化反应
C.电流由锌极流向碳极
D.H2在Zn片上生成
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三考前热身(五模)化学试卷(解析版) 题型:选择题
用下列装置进行相应实验,能达到实验目的的是
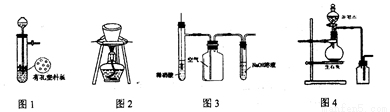
A. 图1所示装置用于Cu和浓硫酸反应制取少量的SO2气体
B. 图2装置用于除去碳酸氢钠固体中的少量碳酸钠
C. 图3装置用于制备并收集NO气体
D. 图4所示装置制取并收集氨气
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:简答题
锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某硫化锌精矿的主要成分为ZnS(还含少量 FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为___________。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作。
(3)浸出液“净化”过程中加入的主要物质为锌粉,其作用是__________________,反应的离子方程式为____________________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用 Pb-Ag 合金惰性电极,阳极逸出的气体是___________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为________。
(6)硫化锌精矿(ZnS)遇到硫酸铜溶液可慢慢地转变为铜蓝(CuS)。请用简短的语言解释该反应发生的原理_______________________。
(7)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为____________。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:填空题
A、B、C、D均为短周期元素,他们的原子序数依次增大,B是构成物质种类最多的元素,B和A组成的化合物 B6 A 6 是一种无色透明的液体,不溶于水,密度比水小,C 是地壳中含量最高的非金属元素,D 在同周期元素中原子半径最大。
(1)A、B、D 的元素名称分别为___________、____________、___________
(2)C 在元素周期表中位置为___________________。
(3)A、C、D 能组成多种不同的化合物,这些化合物中既含有极性共价键又含有离子键的化合物为_______________(写电子式,下同),既含有非极性共价键又含有离子键的化合物为_________________。
(4)A 和 D 能组成一种化学活性很高的离子化合物 DA,DA 能和C的单质 C2反应生成一种强碱,请写出 DA 和 C2反应的化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.按照系统命名法, 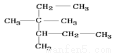 的名称为2,3—二甲基—2—乙基戊烷
的名称为2,3—二甲基—2—乙基戊烷
B.除去苯中 的方法:加溴水,充分振荡,静置分液。
的方法:加溴水,充分振荡,静置分液。
C.1mol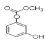 最多能与4mol氢氧化钠反应。
最多能与4mol氢氧化钠反应。
D.苯乙烯中所有原子不可能共平面
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下冲刺模拟理综化学C卷(解析版) 题型:选择题
设NA为阿伏加罗常数的值,下列说法正确的是( )
A.34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NA
B.反应3H2(g)+N2(g) 2NH3(g) △H=-92kJ/mol,若放出热量4.6kJ,则转移电子数目为0.3NA
2NH3(g) △H=-92kJ/mol,若放出热量4.6kJ,则转移电子数目为0.3NA
C.常温常压下,28g乙烯与丙烯的混合气体中含有的碳原子数目无法计算
D.6.4gCu与40mL10mol•L-1浓硝酸作用能生成NO2的分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳二中高一6月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.其它条件相同时,增大反应物浓度能使分子获得能量,活化分子百分数提高,反应速率增大
B.判断过程的自发性能确定过程能否发生和过程发生的速率
C.体系有自发地向混乱度增加(即熵增)的方向转变的倾向,这是自然界的普遍规律
D.催化剂不影响反应 活化能,从而只影响反应速率,不影响化学平衡
活化能,从而只影响反应速率,不影响化学平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com