
【题目】下列叙述正确的是( )
A.Na2O与Na2O2都是碱性氧化物
B.生石灰能与水反应,可用来干燥氨气
C.从海水中提取物质都必须通过化学反应才能实现
D.氯化铝是一种离子型电解质,可用于电解法制铝
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
反应1: Fe2O3(s)+3C(石墨,s) ![]() 2Fe(s)+3CO(g) △H1
2Fe(s)+3CO(g) △H1
反应2: C(石墨,s)+CO2(g)![]() 2CO(g) △H2
2CO(g) △H2
①△H= _________(用含△H1、 △H2代数式表示)
②保持温度不变,在恒容容器中进行反应1,达到平衡状态,再次充入一定量的CO (Fe足量),则平衡_________移动(填“正向”或“逆向”),达到新平衡后c(CO)将_________(填“变大”、“变小”或“不变”)
(2)在T℃时,反应 Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为_________
②下列说法正确的是_________(填字母)。
A.若容器压强恒定,说明反应达到平衡状态
B.增加Fe2O3的量能提高CO的转化率
C.甲容器中CO的平衡转化率大于乙的平衡转化率
D.若容器中固体质量不再改变,说明反应达到平衡状态
③取五等份CO,分别加入温度不同但容积相同的恒容密闭容器中(已装有足量Fe2O3),反应相同时间后,分别测定体系中CO的体积分数(CO%),并作出其随反应温度(T)变化的关系图,请在答题卡中作出平衡时混合气体的平均相对分子质量随反应温度(T)的变化示意图。
_________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=1无色透明溶液中能大量共存的离子组是( )
A.Al3+、Ag+、NO3﹣、Cl﹣
B.Mg2+、NH4+、NO3﹣、Cl﹣
C.Ba2+、K+、S2﹣、Cl﹣
D.Cu2+、Na+、NO3﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。下列说法不正确的是( )

A.通入N2的电极发生的电极反应式为:N2+6e-+8H+=2NH4+
B.反应过程中溶液的pH会变大,故需要加入盐酸
C.该电池外电路电流从通入H2的电极流向通入N2的电极
D.通入H2的电极为负极,A为NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3俗名纯碱,下面是对纯碱采用不同的分类法进行分类,其中不正确的是( )
A.Na2CO3是碱
B.Na2CO3是盐
C.Na2CO3是钠盐
D.Na2CO3是碳酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注。
(1)已知:①2Cu(s)+1/2O2(g)=Cu2O(s) △H=-169kJ/mol
②C+1/2O2(g)=CO(g) △H=-110.5kJ/mol
③Cu(s)+1/2O2(g)=CuO(s) △H=-157kJ/mol
用炭粉在高温条件下还原CuO的方法制得纳米级Cu2O的热化学方程式为_______________。
(2)采用离子交换膜控制电解液中OH-的浓度也可以制备纳米级Cu2O,装置如图所示:
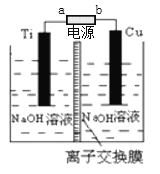
为保证电解能持续稳定进行,若电解槽中的离子交换膜只允许一种离子通过,则该交换膜应为_____ (填“Na+”或“H+”或“OH-”)离子交换膜,该电池的阳极反应式为_______。
(3)用Cu2O做催化剂,工业上在一定条件一下,可以用一氧化碳与氢气反应合成甲醇:
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)

①甲图是反反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=_________。
②乙图表示该反应进行过程中能量的变化。请在乙图中画出用Cu2O作催化剂时“反应过程——能量”示意图_________。
③温度升高,该反应的平衡常数K_____(填“增大”、“不变”或“减小”)。
④ 某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则该反应在该温度下的平衡常数为_____(保留一位有效数字)。相同温度下,若向上述2L密闭容器中加入4molCO、3molH2、1molCH3OH,反应开始时,v(正)____v(逆)(填“大于”、“小于”或“等于”)。
⑤ 在容积均为1L的a、b、c、d、e,5个密闭容器中都分别充入1molCO和2molH2的混合气体,控温。图丙表示5个密闭容器温度分别为T1~T5、反应均进行到5min时甲醇的体积分数,要使容器c中的甲醇体积分数减少,可采取的措施有___________。
⑥ 据研究,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是_______(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
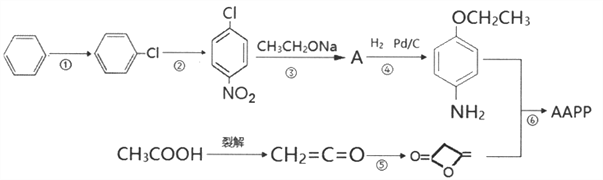
【题目】4-乙氧基乙酰乙酰苯胺(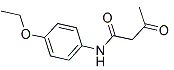 ),简称AAPP,常用作染料、有机颜料中间体。其合成路线如下:
),简称AAPP,常用作染料、有机颜料中间体。其合成路线如下:
已知: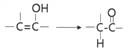
回答下列问题:
(1)下列有关说法正确的是_________
A.反应③是取代反应,反应⑤是加成反应
B.1mol苯完全燃烧需要6molO2
C.CH3COOH不能与新制Cu(OH)2浊液反应
D.CH2=C=O在一定条件下能生成乙醇
(2)反应②的反应条件是_________
(3)A的结构简式_________
(4)反应⑥的化学方程式_________
(5)![]() 有多种同分异构体,写出三种符合下列要求的同分异构体_________
有多种同分异构体,写出三种符合下列要求的同分异构体_________
a.链状化合物 b.能发生银镜反应,但不能在稀硫酸中水解 c.不能与Na反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是

A. 利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C. 图c中的X极若为负极,则该装置可实现粗铜的精炼
D. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A 是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。

请回答下列问题:
(1)写出A的结构简式 。
(2)B、D分子中的官能团名称分别是 , 。
(3)物质B可以被直接氧化为D,需要加入的试剂是 。
(4)写出下列反应的化学方程式:
① ;反应类型: 。
④ ;反应类型: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com