
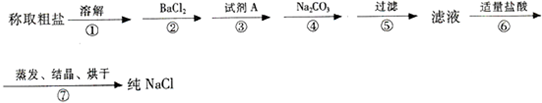
| O | 2-4 |
| A.①④②⑤③ | B.②⑤④①③ | C.⑤②①④③ | D.④①②⑤③ |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
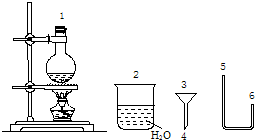
| ||
| △ |
| 密度/g?mL-1 | 沸点/℃ | 溶解性 | |
| 溴乙烷 | 1.461 | 38 | 难溶于水 |
| 乙醇 | 0.789 | 78 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验步骤 | 有关问题 |
| (1)计算所需KCl的质量 | 需要KCl的质量为______g |
| (2)称量KCl固体 | 称量过程中主要用到的仪器是: ______ |
| (3)将KCl加入100mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施: ______ |
| (4)将烧杯中溶液转移至500mL容量瓶中 | 为了防止溶液溅出,应采取什么措施: ______ |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意什么问题: ______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com