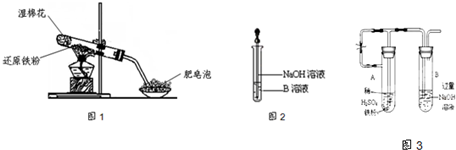
某同学利用如图1所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.
已知:①FeO+2H
+=Fe
2++H
2O②Fe
2O
3+6H
+=2Fe
3++3H
2O ③Fe
3O
4+8H
+=Fe
2++2Fe
3++4H
2O
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为
.
(2)该同学欲确定反应一段时间后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意)
A
A
,若溶液未变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意)
C
C
.
A.一定有Fe
3O
4,可能有Fe B.只有Fe(OH)
3C.一定有Fe
3O
4和Fe
D.一定有Fe(OH)
3,可能有FeE.只有Fe
3O
4(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是
Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
(用离子方程式表示).
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应.若按图2所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3
.
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe
2+具有
还原
还原
性.由此可知,实验室中含Fe
2+的盐溶液需现用现配制的原因是
Fe2+易被空气中的氧气氧化而变质
Fe2+易被空气中的氧气氧化而变质
,并且配制含Fe
2+的盐溶液时应加入少量
铁粉
铁粉
.
(6)乙同学为了获得持久白色的Fe(OH)
2沉淀,准备用图3所示装置,用不含O
2的蒸馏水配制的NaOH溶液与新制的FeSO
4溶液反应.获得不含O
2的蒸馏水的方法是
把蒸馏水煮沸
把蒸馏水煮沸
.反应开始时,打开止水夹的目的是
利用铁粉和稀硫酸反应产生的氢气排出试管A、B中的空气,防止Fe(OH)2被空气中氧气氧化
利用铁粉和稀硫酸反应产生的氢气排出试管A、B中的空气,防止Fe(OH)2被空气中氧气氧化
;
一段时间后,关闭止水夹,在试管
B
B
(填“A”或“B”)中观察到白色的Fe(OH)
2.





