碳的多样性体现了物质世界的多样性.
(1)C、Si、N三种元素的电负性由大到小的顺序为
.
(2)2010年诺贝尔物理学奖所指向的是碳的又一张奇妙面孔;人类已知的最薄材料--石墨烯.
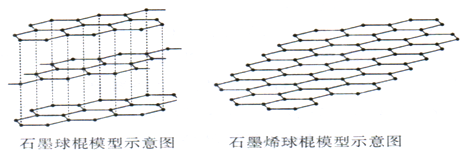
①下列说法中,正确的是
.(填标号)
A.碳各种单质的晶体类型相同 B.石墨烯含有非极性键
C.从石墨剥离得到石墨烯需要破坏化学键 D.石墨烯具有导电性
②石墨烯中,每个碳原子通过
杂化与周围碳原子成键,12g石墨烯含σ键数约为
.
③化学气相沉积法是获得石墨烯的有效方法之一,催化剂可以用金、铜等金属.根据下表数据,铜的第一电离能 (I
1) 小于锌的第一电离能,试解释铜的第二电离能(I
2)却大于锌的第二电离能的主要原因
.
| 电离能/KJ?mol-1 |
I1 |
I2 |
| 铜 |
746 |
1958 |
| 锌 |
906 |
1733 |
(3)CO与N
2相似,分子中都存在一个共价叁键,CO分子中含
个π键.分析下表中的有关数据,说明CO 的化学性质比N
2活泼的原因:
.
| 化学键 |
C-O |
C=O |
C≡O |
| 键能/KJ?mol-1 |
351 |
803 |
1071 |
| 化学键 |
N-N |
N=N |
N≡N |
| 键能/KJ?mol-1 |
159 |
418 |
946 |



